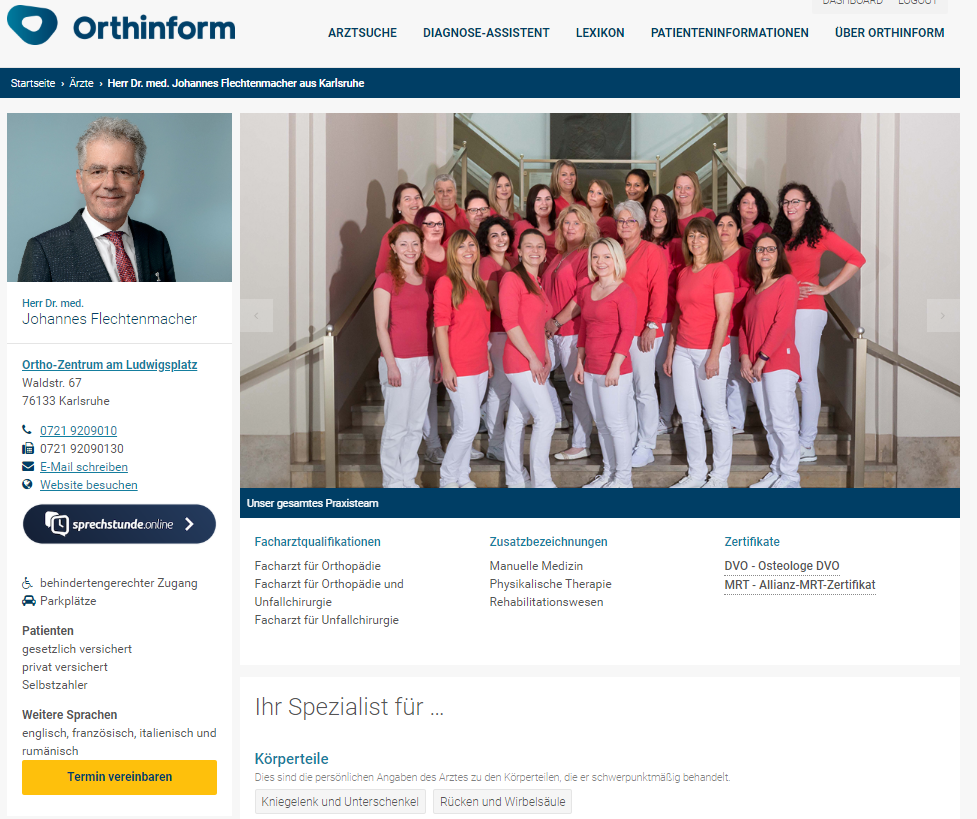
Beim DVO Kongress 2019 in Frankfurt stellte Dr. Friederike Thomasius, Frankfurt, die Arbeiten an der neuen Osteoporose-Leitlinie vor.
Der Focus der Leitlinien liegt zum einen bei Hochrisikopatienten und dem Auftreten einer osteoporotischen Erstfraktur, zum anderen in der Neubewertung von Risikofaktoren. Aus diesem Grund wurden alle schon bekannten Risikofaktoren in Bezug auf ihr relatives Frakturrisiko neu bewertet und um weitere Risikofaktoren wie kardiovaskuläre Erkrankungen (z. B. Bluthochdruck, Vorhofflimmern, ischämische Kardiomyopathie, Aortenkalzifikation, Pulsrate), Medikamente (z. B. Statine, Antikoagulantien, Kontrazeptiva, Harnsäuremedikamente), Operationen (z. B. Bariatrische Chirurgie) und diätetische Besonderheiten, wie einer veganen Ernährung, sehr umfangreich erweitert.
Die Einteilung der Risikofaktoren soll zukünftig in verschiedenen Priorisierungskategorien erfolgen und mit weiteren Messgrößen wie DXA oder Trabekulärer BoneScore (TBS) abgeglichen werden. Wegen des erheblich komplexeren Risikomodells wird die Risikobewertung in Zukunft digital gestützt erfolgen müssen. Hier wird derzeit intensiv an möglichen Applikationen gearbeitet.
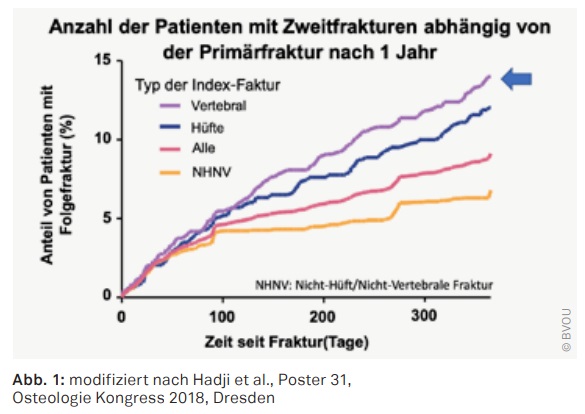
Die diesjährigen Kongresspräsidenten, Prof. Andreas Kurth und Prof. Peymann Hadji, wiesen in ihren Vorträgen auf die Bedeutung der ersten Fraktur hin, da diese mit einer deutlichen Risikosteigerung für Folgefrakturen einhergeht. So traten im ersten Jahr nach diagnostizierter Erstfraktur der Wirbelsäule ca. 15% (RR: 1,95) Folgefrakturen auf. Bei den primären hüftgelenksnahen Frakturen wurden ca. 12% (RR: 1,65) mit Folgefrakturen diagnostiziert. (Abb. 1)
GBA-Beschluss Teriparatid (Forsteo®)
Der Gemeinsame Bundesausschuss (GBA) hat mit Beschluss vom 17.01.2019 (Inkrafttreten 06.04.2019) den Therapiehinweis zu Teriparatid (Forsteo®) aufgehoben.
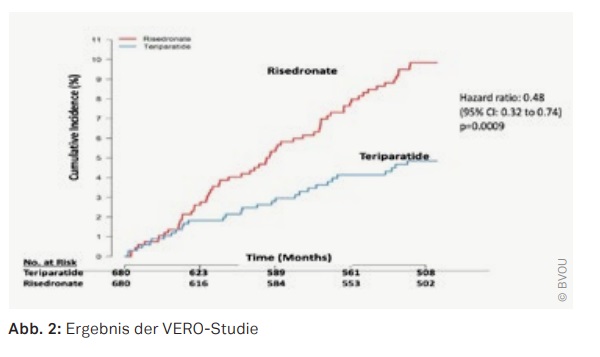
Grund dafür ist im Wesentlichen die VERO-Studie, eine multizentrische Studie, die Kendler DL et al. in The Lancet (2018):391: 230–40 publizierten. Sie untersuchten den Effekt von Teriparatid und Risedronat auf das Neuauftreten von Frakturen bei Patientinnen mit schwerer postmenopausaler Osteoporose. Sie konnten zeigen, dass das kumulative Risiko für eine neue Fraktur bei Teriparatid um 50% unter dem von Risedronat lag (Abb. 2). Die Autoren kommen somit zu dem Ergebnis, dass Teriparatid bei der Behandlung schwerer Osteoporosen und Hochrisikopatienten einen Vorteil gegenüber Risedronat hat.
Die Erkenntnis der VERO-Studie nahm Einfluss auf den neu vorgestellten Konsens der DVO LL-Kommission für die Definition eines „Hochrisikopatienten“:
„Bei Osteoporose-PatientInnen mit dokumentiert deutlich erhöhtem Frakturrisiko, z. B. bei Vorliegen von vertebralen Frakturen, Schenkelhalsfraktur, verringert Teriparatid das Auftreten von Wirbelfrakturen stärker als orale Bisphosphonate. Solchen Fällen ist einer osteoanabolen Therapie mit Teriparatid gegenüber einer oralen Bisphosphonate der Vorzug zu geben. Gleiches gilt bei erhöhtem Frakturrisiko unter geplanter oder laufender GC Therapie >7,5mg Prednisolon/Tag, >3 Monate.“
Aus dieser neuen Definition erhofft man sich eine bessere Versorgung für dieses schwerkranke Patientenklientel. Hoffen wir nur, dass die Prüfgremien dies genauso
interpretieren!
Sequenztherapie
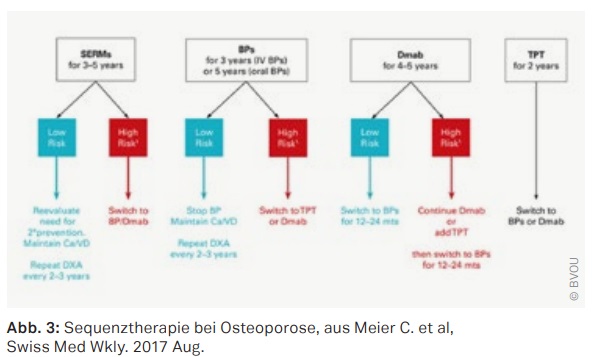
Die Schweizer Arbeitsgruppe um Prof. Christian Meier, Basel, und Prof. Serge Ferrrari, Genf, veröffentlichte einen Positionsartikel der Schweizerischen Vereinigung gegen die Osteoporose (SVGO) zur Sequenztherapie (Meier C. et al, Swiss Med Wkly. 2017 Aug 16;147:w14484.). Sie unterschieden die postmenopausalen Patientinnen in zwei
Gruppen: Die eine Gruppe mit Vortherapie durch ein Medikament mit langanhaltendem Effekt am Knochen, wie die Bisphosphante (BP). Die andere Gruppe mit Präparaten, die nur einen temporären Effekt am Knochen aufwiesen, wie SERMs, Testosteron, Teriparatid, Denosumab und Romosozumab.
Bei den mit BPs vorbehandelten Patienten (oral über fünf Jahre, i. V. über drei Jahre) empfehlen sie bei geringem Risiko ein „drug holiday“ unter Beibehaltung der Basistherapie. Eine klinische Reevaluation sollte nach ein bis zwei Jahren erfolgen. Eine DXA -Messung sollte in diesen Fällen alle zwei bis drei Jahre durchgeführt werden. Die Wiederaufnahme der Behandlung soll erfolgen, wenn die Knochendichte fällt, es wieder zu Frakturen kommt oder gegebenenfalls bei Anstieg der Knochenabbauparameter. Bei Hochrisikopatienten rät die Schweizer Arbeitsgruppe zum Fortführen der Therapie oder zum Wechsel auf Denosumab oder Teriparatid. Als Hochrisikopatienten definieren sie einen Patienten mit einem T-Score am Femurhals von T ≤-2.5 SD, manifeste Osteoporosen unter BP-Therapie oder sekundäre Osteoporosen, insbesondere die glukokortikoid-induzierte Osteoporose (GIOP).
Bei einer Vorbehandlung mit Denosumab über vier bis fünf Jahre wird bei niedrigem Risiko zu einem Wechsel auf BPs geraten. Patienten mit hohem Risiko oder dem Vorliegen von Kontraindikationen gegenüber BPs, ist das Fortführen der Denosumab-Therapie bis zu zehn Jahren oder ein Wechsel auf Teriparatid indiziert. Kontrollen in ein bis zwei Jahresabständen seien empfehlenswert.
Unter der Vorbehandlung mit Teriparatid über zwei Jahre ist eine Anschlusstherapie mit BPs oder Denosumab erforderlich. Hier wir ein Follow-up alle zwei Jahre geraten. (Abb. 3)
Rückschlag in der osteoanabolen Therapie
Die Europäische Arzneimittel-Agentur (EMA) hat erneut ein vielversprechendes osteoanaboles Präparat für den europäischen Markt nicht zugelassen*.
Nach Abaloteriparatid wurde auch Romosozumab, ein monoklonaler Antikörper gegen Sklerostin, nicht von der EMA für den Markt zugelassen. Beide Präparate konnten in klinischen Studien eine Verbesserung der Knochendichte und Frakturreduktion bei postmenopausaler Osteoporose zeigen.
Weiter zeigte Romosozumab in einer Head-to-headStudie gegenüber der Standardtherapie mit Alendronat eine zusätzliche 50%ige Frakturreduktion ohne signifikante Auffälligkeiten bezüglich der kardialen Nebenwirkungen (Saag KG, et al. N Engl J Med. 2017, 377(15):1417-1427). Trotz dieser Studienlage argumentierte die EMA gegen eine Zulassung auf Grund des kardialen Risikoprofils älterer Patienten. Ähnliche Bedenken schien die amerikanische Zulassungsbehörde (FDA) sowie die in Japan und anderen außereuropäischen Ländern nicht zu teilen. Dies ist ein herber Rückschlag für die Weiterentwicklung einer suffizienten Osteoporosetherapie in Deutschland.