Die Künstliche Intelligenz (KI) hat in den letzten Jahren eine rasante Entwicklung durchgemacht und findet mittlerweile in zahlreichen Bereichen Anwendung, so auch in der Medizin. In der Orthopädie und Unfallchirurgie (O&U) bietet KI großes Potenzial, die Bildgebung und deren Auswertung zu verbessern und die damit verbundenen Prozesse zu optimieren.
Jetzt schon können KI-basierte Systeme Bilder automatisch analysieren und auffällige Befunde erkennen. Dies kann zu einer schnelleren und präziseren Diagnose führen. Darüber hinaus kann KI helfen, die Bildgebung zu standardisieren und die Qualität der Befundung zu verbessern.
Die Entwicklung von KI-Anwendungen in der Bildgebung befindet sich noch in einem frühen Stadium, aber das Potenzial ist enorm. Insbesondere in der Optimierung von schnelleren und präziseren Diagnosen, Entlastung von Radiologen und Orthopäden bei der Befundung der durchgeführten Bildgebung als auch in der Verbesserung der Patientensicherheit liegen die aktuellen Hoffnungen. Nicht zuletzt ermöglicht die tiefergehende Analysefähigkeit der KI die Identifizierung neuer Muster und Zusammenhänge in den Bildgebungsdaten, was die Entwicklung innovativer Therapieansätze und die Personalisierung von Behandlungen vorantreiben könnte.
In diesem Artikel werden wir die technischen Hintergründe von KI-Anwendungen in der Bildanalyse erörtern. Darüber hinaus werden Beispiele aus aktuellen schon bestehenden Anwendungen aus der Praxis wie aus der Wissenschaft vorgestellt. Abschließend trauen wir uns einen Blick in die Zukunft zu werfen und mögliche Entwicklungen in den nächsten 10 Jahren auf diesem Gebiet in unserem Fachgebiet zu skizzieren.
Grundprinzipien der Künstlichen Intelligenz
Ausgewählte Formen der Künstlichen Intelligenz
Maschinelles Lernen (ML) ist ein Teilbereich der Künstlichen Intelligenz (KI), der sich mit der Entwicklung von Algorithmen befasst, die aus Daten lernen und sich im Laufe der Zeit verbessern können. ML-Algorithmen lernen aus explizit bereitgestellten Datensätzen mit definierten Merkmalen. Als Anwendungsbereiche für ML eignet sich für Aufgaben mit klar definierten Regeln und Merkmalen.
Deep Learning (DL) ist eine Unterart des Maschinellen Lernens, wobei tiefe neuronale Netzwerke mit vielen Schichten verwendet werden, um komplexe Muster in Daten zu erkennen. Neuronale Netze sind eine abstrakte Darstellung des menschlichen Gehirns. Sie bestehen aus vielen miteinander verbundenen künstlichen Neuronen, die Informationen verarbeiten und weiterleiten. Deep Learning Modelle besitzen die Möglichkeit eine automatisierte Merkmalsextraktion und Mustererkennung in großen Datenmengen durchzuführen. Diese Technik hat sich als besonders wirkungsvoll in der medizinischen Bildanalyse erwiesen. Convolutional Neuronal Networks (CNNs) sind DL Modelle, die speziell für die Verarbeitung von Bilddaten konzipiert sind, um automatisch komplexe Merkmale aus Bildern zu extrahieren.
Spezifische Lernmethoden in der Anwendung von Künstlicher Intelligenz
Beim Supervised Learning wird der Algorithmus mit einer großen Menge von gelabelten Daten trainiert, d.h., jede Eingabe (z. B. ein Bild) ist mit einem Label (z. B. die Diagnose) verknüpft. Der Algorithmus lernt, die Eingabedaten anhand der Labels zu klassifizieren oder Vorhersagen zu treffen. Diese Methode wird häufig verwendet, um Modelle zu trainieren, die spezifische Erkrankungen in medizinischen Bildern identifizieren.
Im Gegensatz dazu verwendet Unsupervised Learning ungelabelte Daten. Der Algorithmus versucht, Muster oder Strukturen in den Daten selbstständig zu finden, ohne vorherige Kennzeichnung. Diese Technik eignet sich gut für die Erkennung von Anomalien oder für die Segmentierung, bei der Bilder in relevante Abschnitte unterteilt werden, ohne dass spezifische Diagnoseetiketten verwendet werden.
Reinforcement Learning (RL) ist ein Teilgebiet des maschinellen Lernens, bei dem es darum geht, das bestmögliche Verhalten in einer bestimmten Situation zu lernen, um die größtmögliche Belohnung zu bekommen. Anders als bei anderen Lernmethoden, bei denen aus klaren Beispielen gelernt wird, probiert hier ein „Agent“ verschiedene Handlungen aus und lernt aus den Konsequenzen – Belohnungen für gute Entscheidungen und Strafen für schlechte. RL hat in der Medizin aktuell noch wenige Anwendungsfälle. Jedoch in anderen Bereich wie autonomes Fahren und Automatisierung industrieller Prozesse hat es vielfältige Verwendung.
Segmentierung und Bildklassifikation
Segmentierung und Bilddatenklassifikation sind fundamentale Methoden in der medizinischen Bilddatenanalyse. Sie spielen eine entscheidende Rolle bei der automatisierten Auswertung von Röntgenbildern, MRT und CT-Scans. Somit können diese Anwendungen in Zukunft die die Diagnosestellung als auch die Planung und Therapie in der Orthopädie und Unfallchirurgie unterstützen.
Das Ziel der Segmentierung ist es, ein Bild in mehrere Segmente oder Bereiche zu unterteilen, die jeweils bestimmte Eigenschaften teilen, wie z. B. Farbe, Intensität oder Textur. Diese Bereiche repräsentieren oft spezifische Objekte oder Teile eines Objekts im Bild.
Das Ziel der Bildklassifikation ist es, ein ganzes Bild oder bestimmte Objekte in einem Bild einer von mehreren Kategorien (Klassen) zuzuordnen. Dies kann von einfachen Klassifizierungen wie „Tier“ oder „Fahrzeug“ bis hin zu spezifischeren Kategorien wie „Katze“ oder „Auto“ reichen.
In der Literatur sind in den letzten Jahren zunehmend erste Anwendungsversuche von KI-Systemen in der Orthopädie und Unfallchirurgie publiziert worden.
Gelenkrekonstruktion
Im Bereich der Gelenkrekonstruktion werden hauptsächlich Use-Cases in Bezug auf die Bildanalyse, Evaluation von Implantaten und im Bereich des vorhersagenden Behandlungsverlaufsverlaufs veröffentlicht.
Im Kontext der Bildanalyse werden Einsatzmöglichkeiten insbesondere der Identifizierung von Gelenkpathologien, Achs- und Gelenkstellung und Implantaterkennung zugeordnet. Im Bereich der Bildanalyse von nativradiologischen Bildern mit einem CNN-Model wurden vielversprechende Daten bei der automatischen Erkennung von Arthrosestadien im Bereich der Hüfte (Xue et al. 2017) (Üreten et al. 2020) und dem Kniegelenk (Swiecicki et al. 2021) veröffentlicht. Auch erste kommerzielle Anbieter in diesem Bereich sind auf dem Markt.
Ein weiterer Ansatz ist die Evaluation der Röntgenbilder nach Implantation eines Gelenkersatzes auf Lockerungsanzeichen im Verlauf. Auch hier konnte schon gezeigt werden, dass ein trainiertes CNN-Modell zuverlässig mit einer Sensitivität von 94 % und eine Spezifität von 96 % diese radiologischen Anzeichen erfassen kann (Borjali et al. 2019).
Im Bereich der Vorhersage von Patientenverläufen hat eine Studie mit Daten von 17.443 Patienten aus der Datenbank des American College of Surgeons National Surgical Quality Improvement Program gezeigt, dass die Wiederaufnahme in ein Krankenhaus nach einer Revisionsoperation bei Kniegelenksimplantaten erfolgreich vorhergesagt werden kann. Dabei kamen vier verschiedene maschinelle Lernmodelle zur Anwendung, um zu demonstrieren, dass solche Vorhersagen mit guter Genauigkeit möglich sind. Das Ziel dieser Studie war es, mit dem Wissen aus der Vorhersage gewisse Risikofaktoren zu therapieren, dass die erneute Aufnahme ins Krankenhaus vermieden werden kann (Chen et al. 2024).
Auch erste Anwendung im Bereich der patienten-spezifischen präoperativen Planung von Gelenkersatz mit einem ML-Algorithmus wurden untersucht. Hier zeigte sich, dass die durchschnittliche Anzahl der Korrekturen, die ein Chirurg, an dem mit KI generierten, präoperativen Plan vornehmen musste, im Vergleich zum Standardplan des Herstellers um 39,7 % reduziert werden konnte. Die Größe des femoralen und tibialen Implantats im Plan des Herstellers war in 68,4 % bzw. 73,1 % der Fälle korrekt, während der auf KI basierende Plan in 82,2 % bzw. 85,0 % der Fälle korrekt war, verglichen mit dem vom Chirurgen genehmigten Plan (Lambrechts et al. 2022).
Wirbelsäule
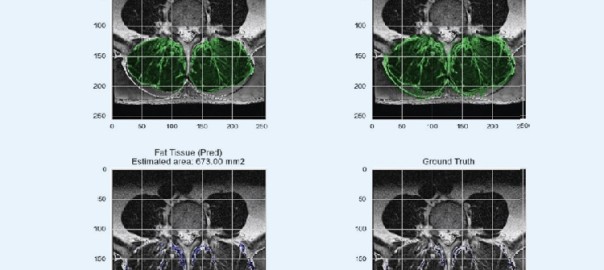
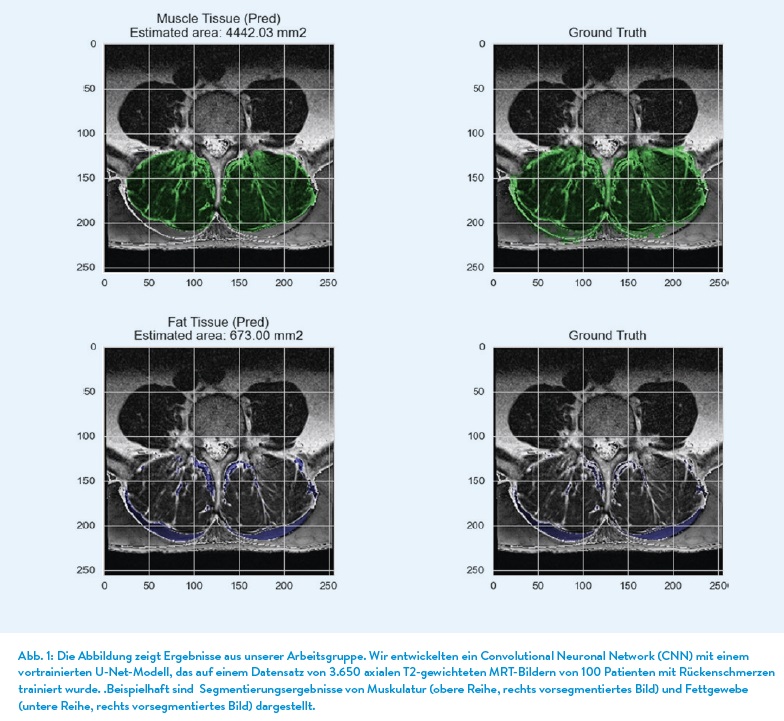
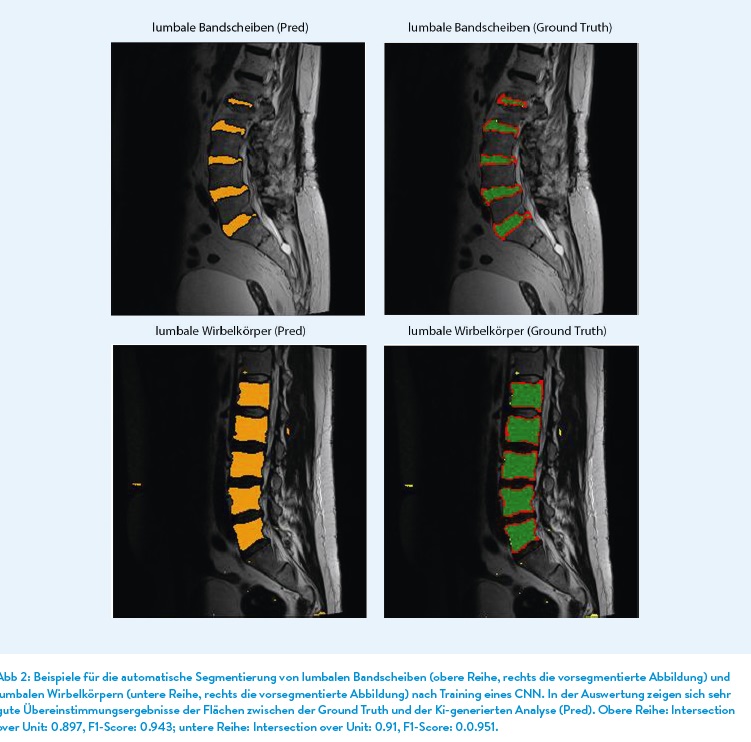
KI-Anwendungen im Bereich der Wirbelsäule werden aktuell vornehmlich in Bezug auf Erkennung von anatomischen Strukturen und der Detektierung von spinalen Pathologien entwickelt. Anatomische Strukturen In den letzten Jahren wurden mittels unterschiedlicher CNN-Modell die Erkennung von Wirbelkörpern (Forsberg et al. 2017), Bandscheiben (Lin et al. 2020), den Spinalkanal und lateralen Recessus (Hallinan et al. 2021) als auch der paravertebralen Muskulatur im MRT-Bild vorangetrieben. Auch bei der Erkennung und der Berechnung des Verfettungsgrades im Bereich der paravertebralen Muskulatur der LWS konnten gute Ergebnisse in einer Studie gezeigt werden (Baur et al. 2022). Bei der Analyse von MRT-Bildern muss man anmerken, dass diese im Vergleich zum nativen Röntgenbild bzw. einem CT-Bild deutlich erschwert ist, da innerhalb eines MRT-Bildes deutlich mehr Informationen über die Gewebe enthalten sind. Zudem kommt hinzu, dass MRT unterschiedliche Arten von Kontrasten verwendet, um verschiedene Gewebe hervorzuheben. Auch sind MRT-Bilder aus unterschiedlichen Untersuchungen und unterschiedlichen Geräten viel variabler als CT-Bilder, was das Training der KI-Anwendungen deutlicher erschwert.
Spinale Pathologien
Zu vielen spinalen Pathologien wurden bisher erste Anwendungen einer automatisieren KI-unterstützen Bildanalyse veröffentlicht. So konnten eine Arbeitsgruppe zeigen, dass degenerative Veränderungen im Bereich der HWS ebenso wie Myelonschädigungen mit einem guten Ergebnis mit einem CNN-Model detektiert werden konnten (Ma et al. 2020). Verschiedene Studien zeigten auch, dass es möglich ist neuroforaminale Stenosen, Facettengelenksarthrosen als auch Spinalkanalstenosen in der MRT Bildgebung mit Hilfe von CNNModellen zu erkennen (Bharadwaj et al. 2023).
Mit verschiedenen Ansätzen und unterschiedlichen KIModellen haben Forschungsgruppen Modell generiert, um die Verkrümmung der Wirbelsäule bei Skoliosepatienten aus verschiedenen Perspektiven anhand von Röntgenbildern zu analysieren und zu vermessen. Weng et al. entwickelte ein Modell mit Hilfe der Architektur eines ResidualNetwork und eines U-Nets Modells für die präzise Messungen der Wirbelsäulenachse, das sich besonders durch seine Zuverlässigkeit bei verschiedenen Deformitätsgraden hervorhebt (Weng et al. 2019). Wu et al. führten ein Netzwerk ein, dass durch die Verarbeitung von verschiedenen Bildansichten, Röntgenaufnahmen aus verschiedenen Perspektiven, analysiert und den Cobb-Winkel sowie Wirbelsäulenmarkierungen präzise bestimmen kann (Wu et al. 2018). Häufig sind bei starken Wirbelsäulenverkrümmungen die einzelnen Wirbelkörper von anderen anatomischen Strukturen wie die Rippenansätze überlagert, was eine automatisierte Auswertung dieser Fälle erschwert. Durch die Verwendung ein Merkmalsfusionsmodul konnte in einer anderen Arbeit die Genauigkeit der Bewertung von Röntgenbildern bei Skoliose verbesserte, indem Informationen aus unterschiedlichen Röntgenansichten effektiv nutzt wurden und unklare Wirbelsäulenpunkte besser identifiziert wurden (Zhang et al. 2022).
Weitere Anwendungsbereiche in O und U
In der orthopädischen Onkologie werden zunehmend KI-basierte Technologien für die bildgestützte Diagnose von Tumoren eingesetzt. Moderne tiefenlernbasierte Algorithmen können primäre Knochentumoren auf Röntgenbildern als gutartig oder bösartig klassifizieren, mit ähnlicher Genauigkeit wie Fachärzte. In Studien von He et al. und Eweje et al. erreichten solche Modelle eine Genauigkeit von über 73 %, was in diesen Untersuchungen der Leistung von spezialisierten Radiologen entspricht. Diese Algorithmen könnten die Diagnose in unklaren Fällen verbessern und invasive Verfahren reduzieren.
Im Bereich der Frakturerkennung wurden beispielsweise beim Training von Deep-Learning-Netzwerken mit Röntgenbildern zur Erkennung spezifischer Frakturtypen mit kleineren Datensätzen hohe Erkennungsgenauigkeiten erzielt. Beispielsweise erreichten CNNs Erkennungsraten von 94,4 % für Femurhalsfrakturen, 95,5 % für intertrochantäre Hüftfrakturen und 96 % für distale Radiusfrakturen (Gan et al. 2019) (Adams et al. 2019). Darüber hinaus haben andere Forscher Deep-Learning-Methoden nicht nur zur Erkennung, sondern auch zur funktionellen Klassifizierung von Fraktursubtypen, wie etwa bei proximalen Humerus-, Fersenbein- und Beckenfrakturen, erfolgreich eingesetzt (Krogue et al. 2020).
Sowohl Verletzungen des vorderen Kreuzbands als auch Meniskusverletzungen zählen zu den häufigsten Pathologien in der Sportmedizin. In jüngerer Vergangenheit wurde erfolgreich demonstriert, dass diese Verletzungen mithilfe von CNN-effektiv in MRT-Bildern erkannt werden können (Minamoto et al. 2022) (Li et al. 2022).
Herausforderungen und Entwicklungen
Die Entwicklung von KI-Anwendungen in der Bildanalyse für Orthopädie und Unfallchirurgie nimmt zunehmend mehr Raum ein. Jedoch steht sie auch vor einigen Herausforderungen, insbesondere hinsichtlich der Datenverfügbarkeit und der Modellgenauigkeit. Nicht wenige Studien über die Implementierung von KI-Modellen zur Bildanalyse stützen sich auf eine begrenzte Anzahl von Patientendaten und Bildmaterial, was das Training der Modelle erschwert und oft zu einer geringeren Genauigkeit führt bzw. müssen n diesen Fällen eine hohe Genauigkeit der Modelle kritisch hinterfragt werden. Trotz dieser Hindernisse haben Fortschritte insbesondere in der Verwendung von Convolutional Neural Networks bereits gezeigt, dass eine effektive Erkennung und Klassifizierung von Pathologien in allen Bereichen unseres Fachgebiets möglich sind. Die Zukunft der Bildanalyse liegt eindeutig in der automatisierten Erfassung und Klassifikation der Pathologien, was nicht nur die Diagnosegenauigkeit verbessern, sondern auch die Behandlungszeiten verkürzen und letztlich zu besseren Diagnose- und Behandlungsergebnissen führen könnte. Um dieses Potenzial voll auszuschöpfen, sind jedoch weitere Forschungen und Entwicklungen erforderlich, insbesondere im Bereich der Datensammlung und des Modelltrainings.
Literatur auf Anfrage bei der Redaktion.