Grundlagen
Für die Behandlung von Knorpelschäden gibt es unterschiedliche OP-Techniken. So können kleine Defekte mittels Mikrofrakturierung, mittelgroße Defekte mittels Mikrofrakturierung und zusätzlicher Abdeckung mit einer Membran behandelt werden (MACI)[2]. Als Goldstandard gilt die Autologe Chondrozyten Transplantation (ACT)[5]. Hierzu gibt es sehr zufriedenstellende Langzeitergebnisse, jedoch handelt es sich um ein zweizeitiges Verfahren mit behördlich regulierten Voraussetzungen[6]. Im Vergleich zu anderen Therapieformen stellt die ACT aufgrund der Zellzüchtung unter Laborbedingungen ein zudem kostenintensives Verfahren dar. Ein weiteres, in den achtziger Jahren durch Albrecht et al. beschriebenes Verfahren, ist die Minced-Cartilage Technik. Hierbei werden Knorpeldefekte – einzeitig – mit autologen Knorpelflakes gefüllt, Knorpel wird dem Patienten entnommen und mit einem Skalpell auf dem Instrumentiertisch in kleine Fragmente geschnitten (geminced). Diese Knorpelfragmente werden anschließend in einen debridierten Defekt eingelegt und mit einem allogenem Fibrinkleber oder einer Membran fixiert[1]. Hierbei handelt es sich um eine offene Operation, eine Arthrotomie ist notwendig. Salzmann et al. konnte hierzu sehr zufriedenstellenden 2 Jahresergebnisse publizierten, aktuell ausgewertet 5 Jahresergebnisse bestätigen das Verfahren auch im längeren Verlauf[11]. Eine Weiterentwicklung dieser Technik stellt sie arthroskopische Minced Cartilage Technik (Autocart) dar. Auch hier wird Knorpel fragmentiert und in einen Defekt eingebracht. Vorteilig handelt es sich hierbei um ein komplett autologes sowie arthroskopisches Vorgehen.
Die AutoCart Prozedur
Zunächst wird eine diagnostische Arthroskopie zur Beurteilung der Defektgröße und Konfiguration durchgeführt[12]. Eventuell vorliegende Komorbiditäten, welche für den Knorpelschaden verantwortlich sind (Achsdeformitäten, Ligamentinstabilitäten, Meniskusverletzungen, etc.) sollten präoperativ detektiert und in einer Sitzung therapiert werden[4]. Nach Beurteilung des Defektes (Abb. 1A) werden die Knorpelzellen mit ihrer umgebenden Knorpelmatrix bei frischen Verletzungen aus dem Defekt selbst sowie dem Randbereich des Defekts entnommen. Bekkers et al. konnte zeigen, dass Knorpelgewebe aus dem Defektrand ein hohes Potential zur Redifferenzierung aufweist, die hier vorhandenen Zellen sind metabolisch aktiv und vital, dies ist Voraussetzung zur Produktion von Kollagen II ist.[3]
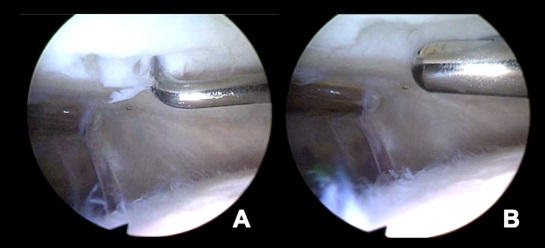
Die Entnahme der Zellen geschieht über einen Shaver (Abb. 1B). Durch die Shaverklingen wird das entnommene Knorpelgewebe fragmentiert. Bereit 2004 konnte durch Redman et al. gezeigt werden, dass das Fragmentieren des Knorpels mit scharfen Klingen zu einem reduzierten Zelltod des Gewebes sowie die Ausbildung der für die Knorpelstabilität notwendigen Extrazellularmatrix gefördert wird[10].
Um die mit dem Shaver gewonnenen Knorpelfragmente aufzusammeln, wird an das Shaverhandstück ein Adapter (Graft-Net Adapter) angeschlossen. Parallel zu diuesem intraartikulären Vorgehen wird dem Patienten Blut abgenommen, um ein Platelet-Rich-Plasma (ACO) herzustellen. Untersuchungen konnten zeigen, dass Thrombozyten einen Hauptbestandteil des Plasmas darstellen. Bestandteil der Thrombozyten sind verschiedene Granula, auf diesen sind Wachstumsfaktoren wie TGF-β, VEGF oder PDGF gespeichert, welche beispielsweise die Kollagensynthese, Zelldifferenzierung positiv beeinflussen und unterstützen somit die Integration der Knorpelmasse[8]. Zu Fixation der Knorpelmasse im Defekt wird autologes Fibrinmaterial verwendet, hierzu wird ebenfalls das gewonnene Plasma verwendet. Ein Teil des PRP wird in einen sogenannten Thrombinator gegeben um im PRP vorhandenes Fibrinogen gemäß der Gerinnungskaskade in Fibrin zu überführen[13]. Mit diesem autologen Fibrin werden die in den Defekt eingebrachten Knorpelzellen beträufelt und somit fixiert. Fortier et al. konnten zeigen, dass die adhäsiven Eigenschaften des autologen Fibrins mechanisch äquivalent zu allogenem Fibrin ist[7].
Um sicherzustellen, dass genug Knorpelgewebe gesammelt wurde, kann das Volumen entweder direkt am Graft-Net Adapter abgelesen werden oder die Knorpelmasse wird direkt aus dem Adapter entnommen, um sie weiter zu verarbeiten. Auf das gesammelte Gewebe werden einige Tropfen des PRP auf die Zellen geträufelt, um sie bestmöglich mit autologen Wachstumsfaktoren zu versorgen (Abb. 2).
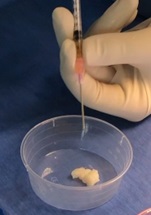
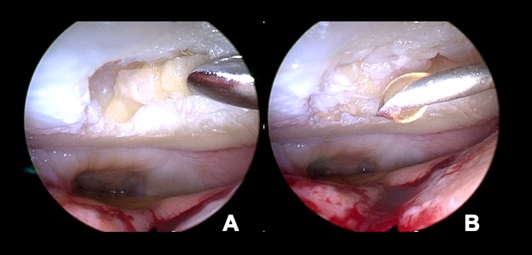
Hierbei sollte darauf geachtet werden, dass nicht zu viel ACP auf die Masse gegeben wird, ist das Produkt zu flüssig, wird es unter Umständen nicht im Defekt haften bleiben. Die adhäsiven, koagulationsbedingten Eigenschaften des ACP sorgen dafür, dass auch retropatellare oder femorale Defekte komplett arthroskopisch zu Füllen sind. Das Beträufelte Material wird anschließend in einen Applikator überführt. Mit diesem werden die Zellen in den Defekt, welcher vorher bis auf die subchondrale Platte z.B. mit einer Kürette debridiert wurde (Abb. 3A), eingebracht und mit demselben oder einem Tasthaken modelliert (Abb. 4A). Vor Einbringen der Knorpelmasse wird die Arthroskopieflüssigkeit aus dem Gelenk entfernt, beispielsweise mit dem Shaver abgesaugt (Abb. 3B). Der Defektgrund sollte mit einem Tupfer getrocknet werden.
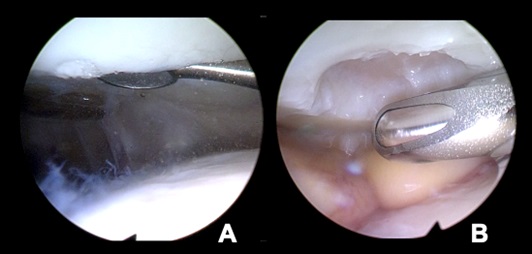
Beim Füllen des Defektes muss dieser nicht bis auf das umgebende Knorpelniveau gefüllt werden. Erste MRT Untersuchungen belegen eine eindrückliche Vitalität und Wachstumseigenschaft des Transplantates, welche bei zu starker Füllung zu einer Hypertrophie führen können. Nach Abschluss der Füllung werden einige Tropfen des Fibrins aus dem Thrombinator entnommen und auf den gefüllten Defekt geträufelt (Abb. 4B).
Abschließend wird der Trokar entnommen, das Gelenk für 24 bis 48 Stunden in einer Orthese ruhiggestellt. Tabelle 1 führt die Nachbehandlung auf.

Ergebnisse
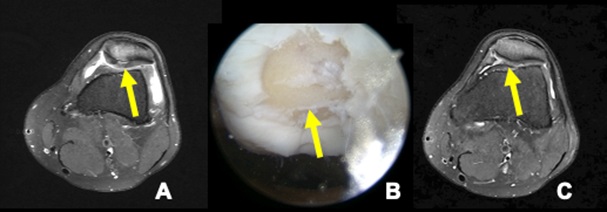
Die ersten Autocart Operationen wurden durch die Autoren vor 3 Jahren durchgeführt. Die versorgten Patienten werden mittels PROMS Verfahren und Nachuntersuchungen verfolgt. Erste Zwei-Jahres Ergebnisse sind zur Zeit in Publikation. Es sei bereits jetzt darauf hingewiesen, dass die erfassten Scores (Tegner Activity Level, SANE, VAS, KOOS) alle sehr zufriedenstellende Verläufe zeigen. Die Erfasste Ergebnisse sind denen von ACT nach 2 Jahren gleichzusetzen. Beispielhaft sind hier Ergebnisse nach Autocart aufgeführt: Abbildung 5 zeigt die Befunde eines 26-jährigen Sportlers auf. Nach einem Anprall eines Surfboards gegen sein Knie beklagte er anhaltende Schmerzen. Der MRT Befund zeigt einen delaminierten Knorpelflake mit deutlichem Knochenmarködem der Patella (Abb. 5A). Intraoperativ zeigte sich ein nach ICRS viertgradiger Knorpelschaden, welcher mittels arthroskopischer Minced Cartilage Therapie versorgt wurde (Abb. 5B). Ein Jahr postoperativ lässt sich in der MRT Kontrolle ein komplett gefüllter Defekt, ohne verbleibendes Knochenmarködem, erkennen (Abb. 5C). Der Patient hat seine sportliche Belastung (Joggen, Surfen) nach 10 Monaten wieder aufgenommen.
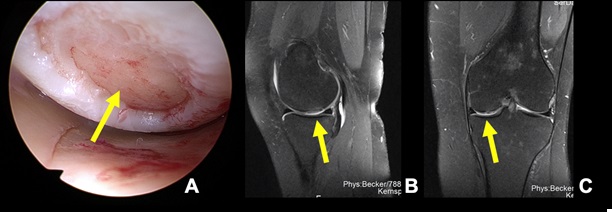
Die Technik ist für alle Lokalisationen von Knorpelschäden im Kniegelenk geeignet. Abbildung 6A zeigt den intraoperativen Befund einer 64-jährigen Patientin mit einem viertgradigen Knorpelschaden der Femurkondyle auf. Hier wurde ebenfalls die arthroskopische Minced Cartilage Technik durchgeführt. Abbildungen 6B+C belegen eine komplette Defektfüllung 7 Monate postoperativ ohne verbliebenes Knochenmarködem. Die Patientin beklagt keine Schmerzen und hat ihr präoperatives sportliches Niveau wieder erreicht. Somit scheint die biologische Behandlung von Knorpelschäden mittels AMCT auch bei älteren Patienten eine sichere, minimalinvasive und valide Methode zu sein.
Zusammenfassend lässt sich sagen, dass die Autocart-Technik eine vielversprechende Versorgungsmöglichkeit von Knorpelschäden darstellt. Langzeitergebnisse der offene Versorgungstechnik zeigen sehr zufriedenstellende Ergebnisse im klinischen sowie radiologischen Follow-Up[9]. Aufgrund der geringen Invasivität des arthroskopischen Eingriffs beklagt die Vielzahl der Patienten postoperativ keine Schmerzen. Es handelt sich um eine komplett autologe, minimalinvasive und für die Patienten nicht belastende Operation.
Referenzen:
- Albrecht FH (1983) [Closure of joint cartilage defects using cartilage fragments and fibrin glue]. Fortschr Med 101:1650–1652
- Basad E, Ishaque B, Bachmann G, Stürz H, Steinmeyer J (2010) Matrix-induced autologous chondrocyte implantation versus microfracture in the treatment of cartilage defects of the knee: a 2-year randomised study. Knee Surg Sports Traumatol Arthrosc 18:519–527
- Bekkers JEJ, Saris DBF, Tsuchida AI, van Rijen MHP, Dhert WJA, Creemers LB (2013) Chondrogenic Potential of Articular Chondrocytes Depends on Their Original Location. Tissue Eng Part A 131114064953008
- Bode G, von Heyden J, Pestka J, Schmal H, Salzmann G, Südkamp N, Niemeyer P (2015) Prospective 5-year survival rate data following open-wedge valgus high tibial osteotomy. Knee Surg Sports Traumatol Arthrosc 23:1949–1955
- Brittberg M (2018) Clinical articular cartilage repair—an up to date review. Ann Jt 3:94–94
- Darling EM, Athanasiou KA (2005) Rapid phenotypic changes in passaged articular chondrocyte subpopulations. J Orthop Res 23:425–432
- Irwin RM, Bonassar LJ, Cohen I, Matuska AM, Commins J, Cole B, Fortier LA (2019) The clot thickens: Autologous and allogeneic fibrin sealants are mechanically equivalent in an ex vivo model of cartilage repair. Nukavarapu S (ed) PLOS ONE 14:e0224756
- Leitner L, Gruber G, Lohberger B, Kaltenegger H, Leithner A, Sadoghi P (2019) Klinische Anwendung von Platelet-rich plasma und Wachstumsfaktoren am Bewegungsapparat. Orthop 48:105–116
- Massen FK, Inauen CR, Harder LP, Runer A, Preiss S, Salzmann GM (2019) One-Step Autologous Minced Cartilage Procedure for the Treatment of Knee Joint Chondral and Osteochondral Lesions: A Series of 27 Patients With 2-Year Follow-up. Orthop J Sports Med 7:232596711985377
- Redman SN, Dowthwaite GP, Thomson BM, Archer CW (2004) The cellular responses of articular cartilage to sharp and blunt trauma11Financial support: Engineering and Physical Sciences Research Council (EPSRC) and Smith & Nephew Plc. Osteoarthritis Cartilage 12:106–116
- Salzmann GM, Calek A-K, Preiss S (2017) Second-Generation Autologous Minced Cartilage Repair Technique. Arthrosc Tech 6:e127–e131
- Schneider S, Ossendorff R, Holz J, Salzmann GM (2021) Arthroscopic Minced Cartilage Implantation (MCI): A Technical Note. Arthrosc Tech 10:e97–e101
- Sproul EP, Hannan RT, Brown AC (2018) Controlling Fibrin Network Morphology, Polymerization, and Degradation Dynamics in Fibrin Gels for Promoting Tissue Repair. In Chawla K (ed) Biomater Tissue Eng Springer New York, New York, NY, pp 85–99