Ein Artikel von Dr. Moritz Dau, Rheinfelden und Dr. Kay Uthoff, Hannover
Die Anwendung von PRP (platelet-rich plasma) als therapeutische Maßnahme für Erkrankungen am Bewegungsapparat ist bereits breit etabliert. In der mittlerweile umfangreichen Literatur findet sich eine hohe Evidenz für Behandlungen von Arthrosen (z.B. Gonarthrose), 1,2 Tendinosen (z.B. Tennisellenbogen, Jumpers knee, Achillodynien) und Ligamentosen 3–6. Grundsätzlich ähnliche Strukturen und entsprechende pathologische Veränderungen spielen auch bei Erkrankungen an der Wirbelsäule eine entscheidende Rolle. Zunehmend findet PRP Einzug als erfolgversprechende minimalinvasive Behandlungsalternative an der Wirbelsäule.
Zu den Hauptursachen von Beschwerden an der Wirbelsäule gehört die Segmentdegeneration an der unteren LWS, wobei eine Aktivierung inflammatorischer Prozesse die Schwelle nozizeptiver Schmerzgeneratoren senkt. Die aktivierte lumbale und zervikale Facettengelenksarthrose, aktivierte Costotransversalgelenke, das ISG-Syndrom und der schmerzhafte iliolumbale und sacropelvine Bandapparat gehören dabei zu den Hauptindikationen für PRP-Anwendungen7. Auch bei diskogenen und peri-/neuralen Beschwerden wird PRP erfolgreich appliziert8. Den therapeutischen Nutzen begründet PRP vor allem in seinem hohen Anteil thrombozytenständiger Wachstumsfaktoren. Diese haben sowohl einen antiinflammatorischen als auch einen regenerativ-proliferativen Einfluss auf das betroffene Gewebe und Heilungsprozesse werden angeregt und beschleunigt 9,10.
Für die Wirksamkeit der PRP-Therapie ist eine korrekte und exakte Diagnose essenziell. Diese zu finden kann insbesondere an der Wirbelsäule eine Herausforderung darstellen. Der Schmerzfokus und die in der Bildgebung aufgezeigten pathologischen Veränderungen werden mit der orthopädischen, neurologischen und manualmedizinischen Untersuchung korreliert. Die betroffenen anatomischen Strukturen der spinalen Komponenten (Wirbelkörper, Facettengelenke, Nervenwurzeln, Bandscheiben) sowie angrenzender Weichteile (Muskulatur, Faszien, Ligamente) sollten dabei möglichst exakt identifiziert werden. Die Diagnose kann mittels (therapeutischer) Testinfiltration verifiziert werden. Die erlebte Schmerzfreiheit trägt zu einer guten Compliance des Patienten bei.
BEHANDLUNG DER FACETTENGELENKE
Um erhebliche entzündliche Veränderungen, insbesondere schmerzhaft aktivierte Facettengelenke „zur Ruhe“ zu bringen, werden Kortikosteroidinjektionen häufig erfolgreich eingesetzt. Steroide bewirken jedoch keine Heilungsprozesse und haben darüber hinaus auch chondrodegenerative Effekte, was ihren Einsatz limitiert11. Zahlreiche Studien bestätigen die bessere Langzeitwirkung von PRP-Behandlungen im direkten Vergleich zu Steroiden2. Auch an der Wirbelsäule findet sich eine entsprechende Evidenz 12,13. Im Vergleich der intraartikulären Anwendung von Kortikoiden mit PRP bei Patienten mit Facettensyndrom zeigten Wu et al., dass bei Patienten mit Steroidbehandlung das Schmerzempfinden nach anfänglichem Rückgang wieder kontinuierlich anstieg, während bei Patienten, die mit PRP behandelt wurden, das Schmerzempfinden über den gesamten Beobachtungszeitraum von 6 Monaten kontinuierlich und signifikant abnahm 14. Eine ähnliche Überlegenheit bzgl. des Langzeiteffektes von PRP-Behandlungen konnte auch in der Studie von Braun et al. beobachtet werden9.
Eigene Erfahrungen
Die aktivierte Facettenarthrose stellt an der Wirbelsäule die häufigste Indikation für PRP-Anwendungen dar. In meiner langjährigen persönlichen Erfahrung zeigt sich eine sehr komplikations- und nebenwirklungsarme Anwendung von PRP an Facettengelenken (intra- und periartikulär). PRP hat bei den behandelten Patienten eine oft nachhaltigere Wirkung. In meiner Praxis benutze ich das leukozytenarme PRP von Arthrex, ACP (Autologous Conditioned Plasma), auch aufgrund seiner einfachen Handhabung in der sterilen Doppelkammerspritze. Vor der Behandlung sollte der Patient über eine mögliche initiale Schmerzzunahme und über eine verzögerte Besserung (im Gegensatz zu LA/Steroidinjektionen) informiert sein. Wie auch beispielsweise im Kniegelenk findet sich die größte Wirksamkeit von PRP bei der Behandlung eines mittleren Arthrosegrades. In Anbetracht fortgeschrittener degenerativer Veränderungen, wie beispielsweise einer schweren hypertrophen Facettengelenksarthrose, muss alternativ eine Ablation der „medial branches“ (Facettenrhizotomie) für ein gutes Langzeitergebnis in Betracht gezogen werden10. Die PRP Therapie sollte in ein multimodales Behandlungsprogramm eingebettet sein, um der Ursache der Überlastung entgegen zu wirken. Ein Trainingsprogramm zur Haltungsverbesserung, Rekonditionierung und Verbesserung der muskulären Rumpfstabilität sollte etabliert werden. Eine Übungsbelastung führt in der betroffenen und behandelten Struktur zu einem effizienten und erfolgreichen Remodelling.
Ultraschallgesteuerte Anwendung:
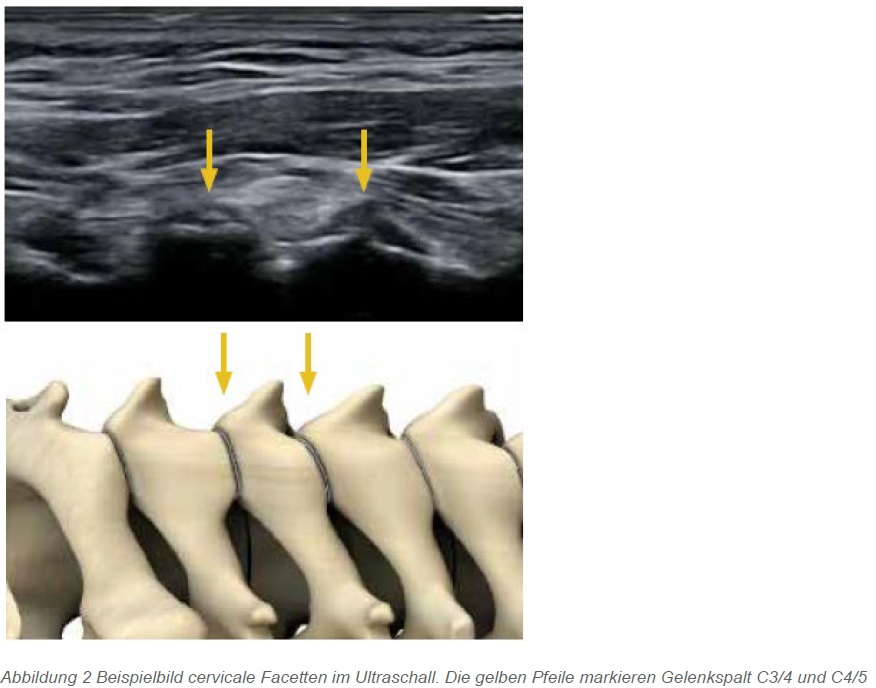
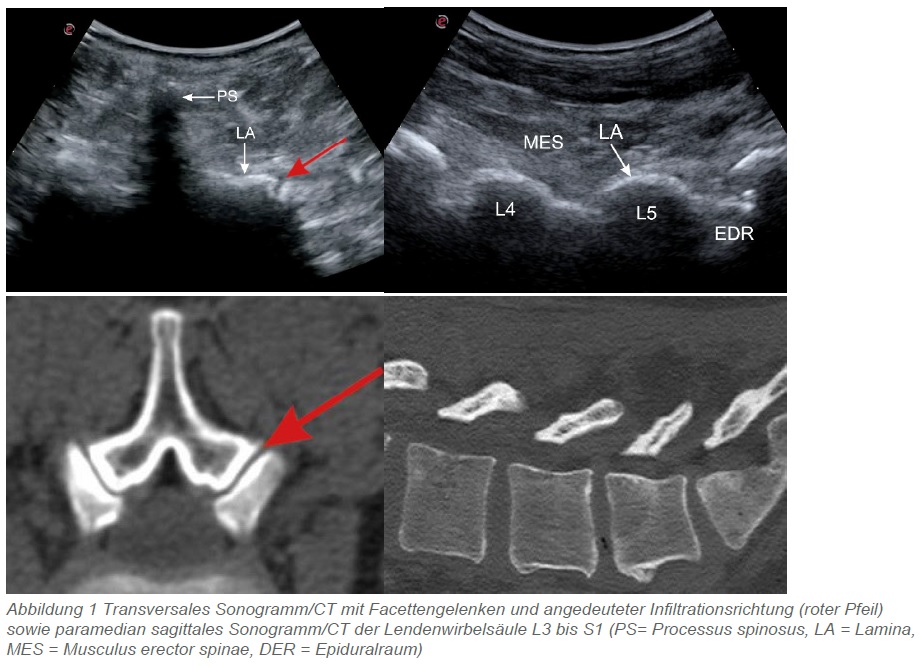
Die Applikationsart kann auf unterschiedliche Weise erfolgen: frei d.h. Landmarken gestützt, ultraschall-, C-Bogen- oder CT-gesteuert. Der Ultraschall entwickelt sich hier zunehmend zur favorisierten Methode. Geräte stehen mittlerweile in den meisten orthopädischen und unfallchirurgischen Praxen zur Verfügung. Die Methode kann schnell und einfach angewendet werden und liefert wertvolle diagnostische Informationen über die betroffene Struktur und vorliegende Pathologie. Eine Behandlung kann unter direkter Sicht, vorzugsweise in der sogenannten „in-plane-Technik“ erfolgen. Bei schlanken und sportlichen Patienten gelingt im Bereich der Wirbelsäule eine gute Darstellung mittels linearem Schallkopf (z. B. 9 bis 12 MHz). Für eine tiefere Darstellung wird eine konvexe Sonde benötigt, die im lumbalen Bereich eine gute Übersicht bietet. Der Vergleich mit einer konventionellen Röntgenaufnahme kann empfohlen werden, um beispielsweise lumbosakrale Überganganomalien oder Skoliosen korrekt zu identifizieren (Abbildung 1). Im zervikalen Bereich bietet der Ultraschall gute diagnostische Eigenschaften. Sowohl degenerative Veränderungen als auch eine Aktivierung der Facettengelenke können sonographisch erkannt werden (z. B. Osteophyten, Ergüsse, Weichteilschwellungen).
 Fallbeispiel: Aktivierte Facettengelenksarthrose C2/3 bei einem 56- jährigen Hobbysportler
Fallbeispiel: Aktivierte Facettengelenksarthrose C2/3 bei einem 56- jährigen Hobbysportler
Der 56-jährige intensive Hobbysportler (Rennrad und Kajak) beklagte bei seiner Erst-Konsultation Ende 2016 einen hochzervikalen Schmerz rechts in die Schulter und Arm ausstrahlend. Mittels Kernspin konnte die Diagnose einer erheblich aktivierten Facettengelenksarthrose C2/3 rechts bestätigt werden. Der Patient entschied sich für eine Behandlung mittels ACP (leukozytenarmes PRP). Eine fünfmalige Behandlungsserie in wöchentlichem Abstand konnte die Beschwerden praktisch vollständig reduzieren. Bis heute kam es einmalig zu einem Rezidiv auf der Gegenseite, das erneut erfolgreich mit einer Dreier-Serie behandelt wurde.
Epidurale ACP Anwendungen
Bandscheibendestruktionen verursachen mechanische neuronale Kompressionen an den Spinalnerven. Bandscheibengewebe löst inflammatorische Kaskaden aus, die eine schmerzhafte Nervenschwellung sowie eine direkte neuronale Aktivierung bewirken. Von Bandscheiben isoliertes neurotoxisches TNF-α kann perinerval eine deutliche Ischialgie auslösen. Die entzündliche Genese von Ischialgie erklärt die weite Verbreitung epiduraler Schmerztherapien mit Kortikosteroiden. Diese bergen jedoch das (geringe) Risiko von Nebenwirkungen und möglichen Komplikationen. Verschiedene Studien zeigen zur perineuralen Anwendung von PRP z.B. beim Karpaltunnelsyndrom gute Ergebnisse. Neben einer klaren klinischen Verbesserung konnte eine signifikante Verbesserung der Elektrophysiologie des Medianusnerves gezeigt werden 15,16. Anjayani S et al. beweisen eine sensorische Reinnervation in Fällen von Lepra-assoziierter Neuropathie nach PRP-Behandlung der betroffenen Nerven17. Bereits 2006 verwendeten Becker et al. epidurales bzw. periradikuläres ACS (inkubiertes Serum) im Vergleich zu Triamcinolon und stützen durch ihre positiven Ergebnisse die These, dass die Ischialgieentstehung durch inflammatorische Prozesse bedingt ist 18. Aufgrund von hohen Kosten und technischem Aufwand setzen sich diese Therapiekonzepte nicht flächendeckend durch. Bhatia et al. führten an 10 Patienten epidurale Injektionen mit PRP durch und wiesen eine klinische Verbesserung in der VAS und des Oswestry Disability Score nach19 . Verschiedene weitere Studien zeigen den Nutzen von PRP bei neuropathischen Schmerzen20. Die aktuelle Literatur zeigt hinsichtlich epiduraler Anwendung ermutigende Ergebnisse. Bise et al. vergleicht die Ergebnisse einer CT gesteuerten interlaminiären Anwendung von PRP mit denen von Steroiden bei Patienten (n=60) mit lumboradiculären Schmerzen. Beide Gruppen zeigten eine signifikante Verbesserung der Symptomatik nach sechs Wochen (NRS and ODI scores). Somit sei bei gleichen Ergebnissen PRP als risikoärmere Therapie vorzuziehen21 .
Eigene Erfahrungen
Die persönliche Herangehensweise ist grundsätzlich variabel und wird individuell angepasst. Verschiedene Faktoren spielen für die optimale Therapiefindung eine Rolle. Eine Behandlung mittels lokalen Steroiden ziehe ich initial vor, sowohl bei einer starken Schmerzsymptomatik (z.B. Lumboischialgie) und großem Leidensdruck, als auch bei einer akuten sensiblen oder motorischen Ausfallsymptomatik. So soll eine rasche Reduktion von Entzündung und Schwellung und damit Entlastung für den betroffenen Nerven erreicht werden. Eine Steroid-Infiltration wird mit einem Lokalanästhetikum kombiniert und gibt Aufschluss über das betroffene Segment (Etagendiagnostik). Der Nutzen der ACP Therapie liegt (entsprechend der Literatur und meiner Erfahrung) im Langzeitergebnis. Die Hauptwirkung tritt erst nach mehreren Wochen ein. Der Patient muss hierüber informiert sein und seine persönliche Situation berücksichtigt werden. Individuell kann im ersten Schritt eine Infiltration mit LA/Steroid gewählt werden, um eine sofortige Schmerzreduktion und damit gute Compliance herbeizuführen. Anschließend kann im zweiten Schritt (falls bei einem Rezidiv nötig) mit PRP weiter behandelt werden. Nach Anwendung eines kristalloiden Steroids, muss allerdings für eine erfolgreiche ACP Therapie am gleichen Ort dessen Abbau abgewartet werden (>6-8 Wochen). Bei Verwendung eines nicht retardierten Glucocorticoids (z.B. Dexamethason) kann bereits früh die PRP-Therapie im Anschluss (z.B. nach einer Woche) erfolgen.
Chronische Neuropathien stellen einen weiteren Anwendungsbereich dar, wobei hier vor allem chronifizierte Ischialgien (und Cervicobrachialgien) als Indikation an der Wirbelsäule zu nennen sind. Der Leidensdruck rechtfertigt einen Behandlungsversuch und ACP kann zu einer guten Langzeitverbesserung führen. Auch postoperativ persistierende Schmerzen entlang der betroffenen Nervenwurzel können behandelt werden. Ein möglicherweise (narbig) veränderter Periduralraum muss bei der Applikation beachtet und eine intratekale Gabe vermieden werden.
Bildgesteuerte Anwendung:
Epidurale (foraminale oder interlaminäre) Infiltrationen sollten bildgesteuert erfolgen. Der Ultraschall, der C-Bogen und die Computertomographie (und MRT) sind geeignet. Die Darstellung der Infiltration mittels C-Bogen ziehe ich vor, wenn ein Steroid/LA-Gemisch verwendet wird. Mittels Kontrastmittel kann die epidurale Ausbreitung (und Selektivität der Etage) abgeschätzt werden. Unter Durchleuchtung kann die Verteilung des Medikaments monitorisiert und eine intravasale Nadellage ausgeschlossen werden. Für ACP Anwendungen ist dies nicht gleichermaßen notwendig und der Ultraschall kann bevorzugt zur Steuerung genutzt werden.
Diskogener Schmerz und Platelet Rich Plasma (PRP/ACP)
Chronischer lumbaler Rückenschmerz (cl-RS) ist eine häufige Krankheitsentität mit hohen sozioökonomischen Belastungen.22,23 2015 war die Prävalenz des cl-RS Erwachsener weltweit bei 7.3%. Seit den frühen 90er Jahre bedeutete dies einen Anstieg um 54 % 24. Etwa 40% der Gesamtpopulation leidet mindestens einmal im Laufe des Lebens an cl-RS 25. Damit wird eine Spitzenposition der globalen Last an Behinderungen besetzt 26. Die Abnutzung des intervertebralen Diskus (IVD) gilt als Initiation der sog. IVD-Degeneration (IVDD). Mit steigendem Alter nimmt die IVDD zu, sodass mehr als 80% der über 50-jährigen bereits Zeichen der IVDD aufweisen. Die IVDD kann also als eine Grundlage der Rückenschmerzengenese gesehen werden. 27,28 Inflammatorische Prozesse und Nervenein-sprossung werden auf diskaler Ebene beobachtet29,30, erhöhte Ausschüttung schmerzauslösender Moleküle kommen hinzu31 . Jüngste Forschung identifizierte inflammatorische Mediatoren und sog. Signal Pathways als wichtige Faktoren in der Entstehung und Unterhaltung der IVDD32. Produkte der Degradation wie IL4, IL-6, IL-12, IFN-γ, und MMPs, führen zur Reduktion der Nukleus palposus (NP) – Zellzahl und zur Zerrüttung des IVD – Mikroenviroments33. Länger dauernde Inflammation führt zur weiteren Rekrutierung von proinflammatorischen Zellen, welche den Entzündungsprozess exazerbieren lassen34. Inflammatorische Mediatoren wie TNF-α und IL-1β induzieren die Expression von schmerzauslösenden Faktoren wie Nitric oxide (NO), Cyclooxygenase 2 (COX-2), und Nerve Growth Factors (NGF), welche für zunehmende Nerveneinsprossung sorgen31. In ihrem destruktiven Zusammenspiel führen diese Faktoren zum lumbalen Rückenschmerz. Die sinnvolle Therapie für den diskogenen Schmerz erfordert also in erster Linie ein gutes Verständnis inflammatorischer Grundlagen der IVDD. Schmerzlinderung und Entzündungshemmung sind auf molekularbiologischer Basis miteinander verbunden. Therapeutisches Ziel muss es also sein, Ergebnisse der Grundlagenforschung in die biologische Reparatur einer Struktur (Diskusregeneration) zu übersetzen und damit Schmerzlinderung verbinden zu können. Dann rückt die rein mechanistische Betrachtung der IVDD zunehmend in den Hintergrund und statt destruktiver Verfahren rücken reparative / regenerative Verfahren in den therapeutischen Vordergrund.
Häufige begleitende „Ischialgien“ beruhen auf entzündliche Affektionen durch den inflammatorischen Prozess im Rahmen der Degradation. So konnte experimentell aus degradierten Bandscheibenpräparaten eine erhöhte TNF-α Konzentration nachgewiesen werden. Diese TNF-α Konzentrate an die Nervenwurzel appliziert führten zu erheblichen Ischialgien35,36.
In den Spätstadien der Degradation werden die Symptome zunehmend multilokulär, überspannen oft große Strecken der Wirbelsäule und werden zunehmend schlechter zugänglich für die lokale Therapie, was in den früheren Stadien mit klar definierbarem Zielort durchaus möglich ist. So ist erklärlich, weshalb lokale Steroidinjektionen eine starke kurzfristige Wirkung erzielen und abhängig von der Akuizität sogar nachhaltig wirken. Bei chronischen Verläufen eignen sich neurodestruktive Verfahren (Facettenrhizotomie) als minimalinvasive Verfahren. Auch systemisch medikamentöse Therapien kommen bei genannten Krankheitsbildern in Frage. So werden ein Großteil der betroffenen Patienten mit chronischen Verläufen und multilokulärer Prävalenz der Schmerzursachen mit NSAR, Opioiden und anderen Analgetika behandelt. Wie bei anderen degenerativen Erkrankungen des Bewegungsapparates werden zunehmend die Risiken solcher systemischen Therapie diskutiert und die Rolle der Lokaltherapie in Form gezielter Injektionen durch Experten favorisiert.
Ein Therapiekonzept mit biologischer Grundlage verspricht die Verbindung antiinflammatorischer mit proliferativen Fähigkeiten eines Sekretoms: Platelet Rich Plasma (PRP).
Auf die Eigenschaften der PRP – Injektate wurde zuvor schon Bezug genommen.
Anwendung von PRP(ACP) bei Rückenschmerz
Diskogener Schmerz bei degenerativer intervertebraler Diskusdegeneration (IVDD)
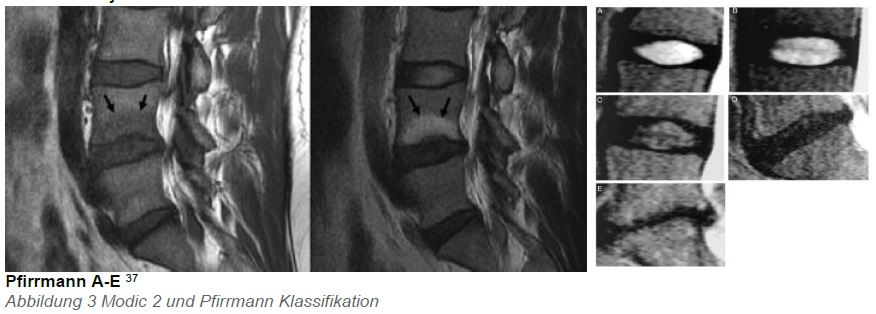
Diskogener Schmerz hat seine Schmerzursache in den degenerativen Veränderungen des intervertebralen Diskus (IVD). Die kernspintomografische Einteilung der Diskusveränder-ungen wird nach der Pfirrmann-Klassifikation vorgenommen37. Ergänzend wird die Einteilung nach Modic zur kernspintomografischen Beurteilung der Endplattenpathologien verwendet38. In der Behandlung der diskogenen Schmerzen mit PRP scheint ein stadiengerechtes Vorgehen verlaufsbestimmend zu sein. So gilt aktuell Modic Grad 1-2 und Pfirrmann Grad B-C als ideale Voraussetzung zur Diskusinjektion mit PRP, wenn zuvor auch ein positiver „Memory Pain“ durch Kontrastmittelinjektion auszulösen war. Patienten ohne Modic Veränderungen und diskogenem Schmerz zeigten im Verlauf nach PRP -Injektionen keinen Unterschied zur Kochsalzinjektion39.
Arnbak et al. zeigten in einer Analyse von 1037 Patienten die steigende Inzidenz des cl-RS mit Zunahme der degenerativen IVD. Middendorp et al. korrelierten den Oswestry Disability Index (ODI) bei Patienten mit cl-RS mit dem Grad der Diskusdegeneration. Ähnlich korrelierte der ODI mit der Pfirrmann Gradierung 37der IVD Degeneration. Laut Studienlage nimmt der Anteil schwerer degenerativer, aber schmerzloser IVD im Alter zu. Meist findet hier die Degeneration in Abwesenheit von Inflammation statt. Zusammenfassend besteht eine starke Korrelation zwischen dem Einwachsen sensorischer Nervenformationen, inflammatorischer Mediatoren und diskogener Schmerzsymptomatik 35.
Platelet-rich Plasma Injektionen der humanen Bandscheibe
Die erste vorläufige prospektive klinische Studie zur Sicherheit und Wirksamkeit von PRP in der intradiskalen Therapie bei diskogenem Kreuzschmerz wurde 2011 von Akeda et al. veröffentlicht40. Die Studie zeigte eine signifikante Senkung der Schmerz Scores (VAS and Roland-Morris Disability Questionnaire [RDQ]) nach 1 und 6 Monaten im Vergleich zu den Ausgangswerten vor der ersten Injektion. In der MRT -Untersuchung zeigte sich in dem Zeitraum keine signifikante Erhöhung der Bandscheibenhöhe in der T2 -Wichtung.
In der Folge zeigte derselbe Autor in einer prospektiven Studie mit 14 Patienten über einen Beobachtungszeitraum von 10 Monaten stabile analgetische Effekte nach intradiskaler PRP- Injektion40. Bemerkenswert zeigte sich nach 10 Monaten mit anhaltendem analgetischem Effekt bei 1 Patienten die Erhöhungen der Bandscheibendicke in der MRT T2, ein anderer Wichtung, bei 2 Patienten überstieg der VAS Score die Ausgangslevel und ein Patient zeigte einen Anstieg des RQD-Scores gegenüber der Baseline. Kein Patient klagte über Nebeneffekte der Therapie und eine weitere Abnahme der Bandscheibenhöheerfolgte in keinem Fall. Es wurde bei der Herstellung der PRP -Konzentration sog. „pure PRP“, also Leukozyten-armes PRP, entsprechend der Dohan-Ehrenfest Klassifikation verwendet41. Unter Verwendung eines sterilen Releasates erfolgte die intradiskale Injektion. Weiterer Vorteil der Releasatverwendung war die Möglichkeit der Konservierung bei -80°.
Bodor et al.42 publizierten Fallreporte in ihren Buchbeiträgen in denen bei 47 thorakalen und lumbalen Bandscheiben von 35 Patienten eine intradiskale PRP Injektion durchgeführt wurde. Pure PRP ohne Leukozyten oder Erythrozyten wurden unaktiviert verwendet. 2/3 der Patienten zeigten einen positiven Effekt in der Numerical Rating Scales (NRS) sowie im Oswestry Disability Index (ODI) Score bezogen auf den erlebten Rückenschmerz nach 1 Woche und 2 Monaten. Weitere Outcomeparameter wurden nicht mitgeteilt.
Navani et al. berichteten in ihrer Fallstudie von 6 Patienten eine 50%ige Verbesserung der VPS (verbal pain scale) Scores stabil nach Injektion bis zum Abschluss des 3. Monats und stabil bis nach 6 Monaten. Sowohl physische als auch mentale Scores (SF-36 questionnaire) zeigten sich zeitgleich verbessert43. Levi et al.44 berichtete in einer prospektiven klinischen Studie mit 22 Patienten den klinischen Effekt intradiskaler Injektionen mit PRP in der Behandlung des diskogenen Kreuzschmerzes. Die PRP – Gewinnung erfolgte mit Smartprep (Harvest, MA, USA), welche Leukozyten reiches PRP(L-PRP) herstellte. Nach 6 Monaten follow-up hatten 47% ein positiver Outcome, definiert als 50%-ige Verbesserung im VAS -Score und 30%ige Verbesserung im ODI. Der Injektion mit 1.5 ml PRP ging eine Injektion mit 0.6 mL Kontrastmittel, 0.4 mL Gentamicin (40 mg/ mL), and 0.5 mL 4% Lidocain wurden zur Bestätigung der Nadellage, zur Diszitisprophyllaxe sowie respektive zur Analgesie injiziert. Die Autoren spekulierten, die Additive könnten ggf. Nebenwirkungen auf die Resultate der Studie ausgeübt haben44. Des Weiteren wurde die Langzeiteffektivität nach intradiskaler PRP – Injektion bei symptomatischer degenerativer Diskuserkrankung in einer randomisierten kontrollierten Studie mit Follow-up zwischen 5-9 Jahren berichtet45. Es gibt Hinweise, die eine positive Korrelation zwischen Plättchenkonzentration des Injektates und positiven Patientenverläufen sehen46. Unlängst erschienen verschiedene Metaanalysen mit Nachweis positiver Entwicklungen der Schmerzentwicklung und Verbesserung der Alltagseinschränkungen bei Patienten mit lumbalem Rückenschmerz. In Ermangelung hochqualitativer Studien konnte Evidenz nur eingeschränkte ermittelt werden47,48. Es bleibt die Forderung nach mehr klinischen Studien, vor allem RCTs mit „multiple Outcome Parameter“ – Analysen49. In einer Singlearm Study konnte bei 42 Patienten mit nachgewiesenem diskogenen Schmerz eine Abhängigkeit der Funktionsverbesserung und der Schmerzreduktion in Abhängigkeit von der PRP Konzentration intradiskal gewonnen werden. Im Durchschnitt hatte die Patientengruppe eine Konzentration von 524.95 ± 232 x 103/ μL (95% CI = 416.3707–633.5293). Somit befanden sich die PRP Proben im Bereich der 2-4 -fachen Konzentration im Vergleich zum Vollblut. Die mittlere Konzentration der Injektate betrug den Faktor 2.69x 46.
Zusammenfassend wurde über acht klinische Studien berichtet, die über Effekte der intradiskalen PRP Therapie bei Kreuzschmerz berichteten. Insgesamt wurde über Kasuistiken und kleine Patientenkollektive berichtet. Eine Doppelblind – randomisierte kontrollierte Studie liegt vor. Die klinische Evidenz für die Behandlung mit intradiskalem PRP ist auch aufgrund der Heterogenität der vorliegenden Studien noch schwach. Dennoch mehren sich klinische Berichte von Anwendern, die über die Sicherheit und Wirksamkeit der Methode berichten. Zukünftig sind große randomisierte und koordinierte klinische Studien unerlässlich, um die klinische Effektivität intradiskaler PRP – Anwendung bei der degenerativen Diskopathie zu klären.
Therapie eines behandlungsresistenten Kreuzschmerzes mit ACP(PRP)
Fallbeispiel: Therapieresistenter lumbaler Rückenschmerz bei einer 38- jährigen Frau.
Diagnose: Diskogener Schmerz L4/5
Seit 2 Jahren unspezifischen Rückenschmerz; keine radikulären Zeichen; lokaler Schmerz über der Lumbalregion; gelegentlich referred pain in die laterale Glutealregion li>re; Physiotherapie erbrachte keine Linderung; NSAR erbrachten kurze Wirkung, wurden bei NW abgelehnt; immer wieder axiale Schmerzen bei Belastung, wechselnd auch Ruheschmerz, aber selten; initialer Belastungsschmerz morgentlich; keine B-Symptomatik; keine Infektzeichen; unauffälliges Blutlabor. BMI 26.
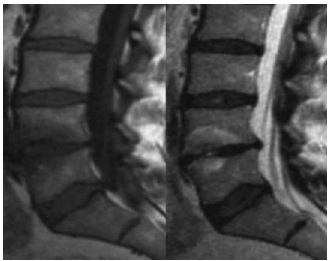
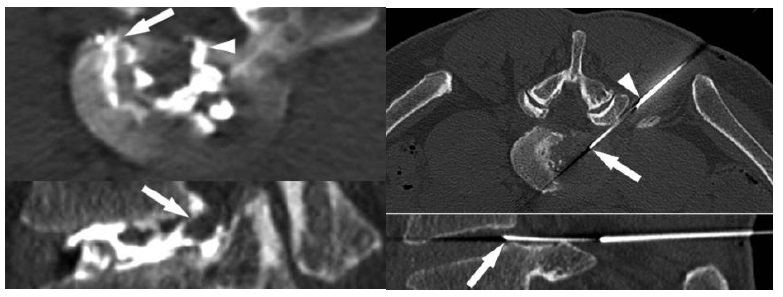
Radiologisch unauff.; funktionelle Manualdiagnostik o.B.; ISG bds. unauff. Stufendiagnostik: Facetteninfiltration L4-S1 bds.: sine effectu; SIG ohne pos. Provokationstest; SIG Infiltration: ergebnislos. Novaminsulfon 500 b.B. VAS zwischen 6 – 9 wechselnd; deutliche Einschränkung im Pflegeberuf bei Heben und Lagern in der Vorneige. MRT LWS mit typischen Modic 1 – Zeichen in T1 und T2; angedeutet HIZ dorsal L4/5 IVD (Abb.1) Indikation zur intradiskalen Schmerzprovokation mit KM L4/5 unter Anwendung der 2- Nadeltechnik im CT von posterolateral: Intradiskale Injektion (2 ml) mit typischem memory pain; anschließend Gentamycininstillation (Abb.2+3) Diagnose: Diskogener Schmerz IVD L4/5 b. Anulusruptur.
Therapie: Indikation zur intradiskalen PRP Therapie mit ACP / Fa. Arthrex
Beginn der Therapie 2 Wochen nach KM – Darstellung unter Ausschluss von ASS und Kortikosteroiden >4 Wo.
Initialer Schmerz nach Injektion für 2 Tage, dann deutlich abklingend. Im Folgenden noch 2 Wiederholungsinjektionen und überlappend posturale Krankengymnastik zur Stabilisierung der Tiefenmuskulatur mit Anleitung zu Eigenübungen.
Insgesamt 3 ACP Injektionen mit LP-PRP je 2 ML intradiskal. Nach 3 Monaten deutlich Schmerzlinderung von max VAS 8-9 auf 4. Funktionell gutes Ergebnis mit voller Arbeitsfähigkeit und ohne weiteren Anlaufschmerz. Nach weiteren 3 Monaten zeigte sich in der Kontrolle eine zufriedene Patientin mit durchgängig VAS 2-3. Nach weiteren 3 Monaten zeigte sich die Patientin bei zuverlässigem Eigentherapieprogramm beschwerdefrei. Mit der Pat. wurde eine Wiederholung der Therapie bei Wiederauftreten von Beschwerden vereinbart.
FAZIT
Aufgrund vielversprechender Ergebnisse sowohl in der täglichen Anwendung als auch in der Literatur ist die Behandlung mit thrombozytenreichem Plasma bei Beschwerden an der Wirbelsäule zunehmend im Fokus. Die aktivierte lumbale und zervikale Facettengelenksarthrose, neuropathische Schmerzen, das ISG Syndrom und der schmerzhafte iliolumbale und pelvine Bandapparat gehören zu den Hauptindikationen für PRP Anwendungen. Die Aktivierung regenerativer Prozesse führt zu einer anhaltenden Reduktion von Schmerz und einer Verbesserung der Funktion. Laut Literatur sind im Vergleich mit der Kortikosteroid-Injektion gerade die Langzeiterfolge besser. Die Basis für eine erfolgreiche Therapie sind eine korrekte Diagnose und eine exakte Behandlung der betroffenen Struktur. Mittels Ultraschall kann an der Wirbelsäule an vielen Stellen eine einfache, schnelle und gezielte Applikation erfolgen. Im eigenen Vorgehen hat sich ACP der Firma Arthrex aufgrund einer sehr risiko- und nebenwirkungsarmen Anwendung bewährt. Die PRP Therapie sollte soweit möglich in ein multimodales Behandlungsprogramm eingebettet sein.
Die Autoren:


Literaturverzeichnis:
1. Smith, P. A. Intra-articular Autologous Conditioned Plasma Injections Provide Safe and Efficacious Treatment for Knee Osteoarthritis. Am. J. Sports Med. 44, 884–891 (2016).
2. Huang, Y., Liu, X., Xu, X. & Liu, J. Intra-articular injections of platelet-rich plasma, hyaluronic acid or corticosteroids for knee osteoarthritis: A prospective randomized controlled study. Orthopade 48, 239–247 (2019).
3. Foster, T. E., Puskas, B. L., Mandelbaum, B. R., Gerhardt, M. B. & Rodeo, S. A. Platelet-rich plasma: from basic science to clinical applications. Am. J. Sports Med. 37, 2259–2272 (2009).
4. Kon, E. et al. Platelet-rich plasma : intra-articular knee injections produced favorable results on degenerative cartilage lesions. 472–479 (2010) doi:10.1007/s00167-009-0940-8.
5. Mishra, A. & Pavelko, T. Treatment of Chronic Elbow Tendinosis With Buffered Platelet-Rich Plasma. 1–5 (2006) doi:10.1177/0363546506288850.
6. De Mos, M. et al. Can platelet-rich plasma enhance tendon repair? A cell culture study. Am. J. Sports Med. 36, 1171–1178 (2008).
7. Singla, V., Batra, Y. K., Bharti, N., Goni, V. G. & Marwaha, N. Steroid vs. Platelet-Rich Plasma in Ultrasound-Guided Sacroiliac Joint Injection for Chronic Low Back Pain. Pain Pract. 17, 782–791 (2017).
8. Yamada, J. et al. Anti-inflammatory properties of platelet rich plasma-releasate on human intervertebral disc cells. J. Orthop. Res. Conf. (2017).
9. Braun, H. J., Kim, H. J., Chu, C. R. & Dragoo, J. L. The effect of platelet-rich plasma formulations and blood products on human synoviocytes: Implications for intra-
articular injury and therapy. Am. J. Sports Med. (2014) doi:10.1177/0363546514525593.
10. Dreyfuss, P. et al. Efficacy and validity of radiofrequency neurotomy for chronic lumbar zygapophysial joint pain. Spine (Phila. Pa. 1976). (2000) doi:10.1097/00007632-200005150-00012.
11. McAlindon, T. E. et al. Effect of intra-articular triamcinolone vs saline on knee cartilage volume and pain in patients with knee osteoarthritis a randomized clinical trial. JAMA – J. Am. Med. Assoc. (2017) doi:10.1001/jama.2017.5283.
12. Wu, T. J. et al. Ultrasound-guided lumbar Intradiscal injection for Discogenic pain: Technical innovation and presentation of two cases. J. Pain Res. 13, 1103–1107 (2020).
13. Tuakli-Wosornu et al. Lumbar Intradiskal Platelet-Rich Plasma (PRP) Injections: a Prospective, Double-Blind, Randomized Controlled Study. PM r 8, 1–10 (2016).
14. Wu, J. et al. A Prospective Study Comparing Platelet-Rich Plasma and Local Anesthetic (LA)/Corticosteroid in Intra-Articular Injection for the Treatment of Lumbar Facet Joint Syndrome. Pain Pract. 17, 914–924 (2017).
15. Malahias, M. A. et al. Platelet-rich plasma ultrasound-guided injection in the treatment of carpal tunnel syndrome: A placebo-controlled clinical study. J. Tissue Eng. Regen. Med. 12, e1480–e1488 (2018).
16. Wu, Y. T. et al. Six-month efficacy of platelet-rich plasma for carpal tunnel syndrome: A prospective randomized, singleblind controlled trial. Sci. Rep. 7, 1–11 (2017).
17. Anjayani, S. et al. Sensory improvement of leprosy peripheral neuropathy in patients treated with perineural injection of platelet-rich plasma. Int. J. Dermatol. 53, 109–113 (2014).
18. Becker, C. et al. Efficacy of epidural perineural injections with autologous conditioned serum for lumbar radicular compression: an investigator-initiated, prospective, double-blind, reference-controlled study. Spine (Phila. Pa. 1976). 32, 1803–1808 (2007).
19. Bhatia, R. & Chopra, G. Efficacy of Platelet Rich Plasma via Lumbar Epidural Route in Chronic Prolapsed Intervertebral Disc Patients-A Pilot Study. J. Clin. Diagn. Res. 10, UC05–UC07 (2016).
20. Kuffler, D. P. Platelet-rich plasma and the elimination of neuropathic pain. Mol. Neurobiol. 48, 315–332 (2013).
21. Bise, S. et al. Comparison of interlaminar CT-guided epidural platelet-rich plasma versus steroid injection in patients with lumbar radicular pain. Eur. Radiol. 2020 306 30, 3152–3160 (2020).
22. Hartvigsen, J. et al. What low back pain is and why we need to pay attention. Lancet (London, England) 391, 2356–2367 (2018).
23. Maher, C., Underwood, M. & Buchbinder, R. Non-specific low back pain. Lancet (London, England) 389, 736–747 (2017).
24. Jackson, T. et al. Prevalence of chronic pain in low-income and middle-income countries: a systematic review and meta-analysis. Lancet (London, England) 385 Suppl 2, S10 (2015).
25. Buchbinder, R. et al. Low back pain: a call for action. Lancet (London, England) 391, 2384–2388 (2018).
26. Foster, N. E. et al. Prevention and treatment of low back pain: evidence, challenges, and promising directions. Lancet (London, England) 391, 2368–2383 (2018).
27. Wuertz, K. & Haglund, L. Inflammatory mediators in intervertebral disk degeneration and discogenic pain. Glob. spine J. 3, 175–184 (2013).
28. Cheung, K. M. C. et al. Prevalence and pattern of lumbar magnetic resonance imaging changes in a population study of one thousand forty-three individuals. Spine
(Phila. Pa. 1976). 34, 934–940 (2009).
29. Richardson, S. M. et al. Degenerate human nucleus pulposus cells promote neurite outgrowth in neural cells. PLoS One 7, (2012).
30. Stefanakis, M. et al. Annulus fissures are mechanically and chemically conducive to the ingrowth of nerves and blood vessels. Spine (Phila. Pa. 1976). 37, 1883–1891 (2012).
31. Khan, A. N. et al. Inflammatory biomarkers of low back pain and disc degeneration: a review. Ann. N. Y. Acad. Sci. 1410, 68–84 (2017).
32. Navone, S. E. et al. Inflammatory mediators and signalling pathways controlling intervertebral disc degeneration. Histol. Histopathol. 32, 523–542 (2017).
33. Cunha, C. et al. The inflammatory response in the regression of lumbar disc herniation. Arthritis Res. Ther. 20, (2018).
34. Molinos, M. et al. Inflammation in intervertebral disc degeneration and regeneration. J. R. Soc. Interface 12, (2015).
35. Olmarker, K. & Rydevik, B. Selective inhibition of tumor necrosis factor-alpha prevents nucleus pulposus-induced thrombus formation, intraneural edema, and reduction of nerve conduction velocity: possible implications for future pharmacologic treatment strategies of sciatica. Spine (Phila. Pa. 1976). 26, 863–869 (2001).
36. Olmarker, K. & Larsson, K. Tumor necrosis factor alpha and nucleus-pulposus-induced nerve root injury. Spine (Phila. Pa. 1976). 23, 2538–2544 (1998).
37. Pfirrmann, C. W. A., Metzdorf, A., Zanetti, M., Hodler, J. & Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine (Phila. Pa. 1976). 26, 1873–1878 (2001).
38. Zhang, Y. H., Zhao, C. Q., Jiang, L. S., Chen, X. D. & Dai, L. Y. Modic changes: a systematic review of the literature. Eur. Spine J. 17, 1289–1299 (2008).
39. Schepers, M. O. et al. Effectiveness of intradiscal platelet rich plasma for discogenic low back pain without Modic changes: A randomized controlled trial. Interv. Pain Med. 1, 100011 (2022).
40. Akeda, K. et al. Intradiscal Injection of Autologous Platelet-Rich Plasma Releasate to Treat Discogenic Low Back Pain: A Preliminary Clinical Trial. Asian Spine J. 11, 380–389 (2017).
41. Dohan Ehrenfest, D. M., Rasmusson, L. & Albrektsson, T. Classification of platelet concentrates: from pure platelet-rich plasma (P-PRP) to leucocyte- and platelet-rich fibrin (L-PRF). Trends Biotechnol. 27, 158–167 (2009).
42. Bodor M, T. A. A. D. D. regeneration with platelets and growth factors. I. L. J. A. S. M. D. B. W. M. L. A. Platelet-Rich Plasma. in Regenerative Medicine: Sports Medicine, Orthopedic, and Recovery of Musculoskeletal Injuries. 265–279 (Springer, 2014).
43. Navani, A. & Hames, A. Platelet-rich plasma injections for lumbar discogenic pain: A preliminary assessment of structural and functional changes. Tech. Reg. Anesth. Pain Manag. 1–2, 38–44 (2015).
44. Levi, D. et al. Intradiscal Platelet-Rich Plasma Injection for Chronic Discogenic Low Back Pain: Preliminary Results from a Prospective Trial. Pain Med. 17, 1010–1022 (2016).
45. Cheng, J., Santiago, K. A., Nguyen, J. T., Solomon, J. L. & Lutz, G. E. Treatment of symptomatic degenerative intervertebral discs with autologous platelet-rich plasma: follow-up at 5-9 years. Regen. Med. 14, 831–840 (2019).
46. Jain, D., Goyal, T., Verma, N., Paswan, A. K. & Dubey, R. K. Intradiscal Platelet-Rich Plasma Injection for Discogenic Low Back Pain and Correlation with Platelet Concentration: A Prospective Clinical Trial. Pain Med. 21, 2719–2725 (2020).
47. Hirase, T., Jack Ii, R. A., Sochacki, K. R., Harris, J. D. & Weiner, B. K. Systemic Review: Is an Intradiscal Injection of Platelet-Rich Plasma for Lumbar Disc Degeneration Effective? Cureus 12, e8831 (2020).
48. Chang, M. C. & Park, D. The effect of intradiscal platelet-rich plasma injection for management of discogenic lower back pain: A meta-analysis. J. Pain Res. 14, 505–512 (2021).
49. Muthu, S. et al. Does the Intradiscal Injection of Platelet Rich Plasma Have Any Beneficial Role in the Management of Lumbar Disc Disease? Glob. spine J. 12, 503–514 (2022).