Behandlung von Sportverletzungen
Die regenerativen Behandlungsstrategien rücken seit einigen Jahren immer mehr in den Fokus bei der Behandlung von Sportverletzungen der Extremitäten. Grund dafür ist u.a. die steigende Anzahl an Studien, die einen negativen Effekt von Lokalanästhetika, NSAR und Kortikosteroide, auf die Heilung von verletzten muskulo-skelettalen Strukturen zeigen, obgleich diese immer wieder Anwendung in der sportmedizinischen Praxis finden. So wissen wir heute um den mitunter fulminaten zytotoxischen Effekt von Lokalanästhetika auf vorgeschädigte Chondrozyten (Kreuz et al., 2018), so dass die Anwendung bei Gelenkinfiltrationen bei Arthrose sehr kritisch gesehen werden muss. Gleiches gilt für den Gebrauch bei Muskelverletzungen und bei der Therapie von Sehnenerkrankungen. Im Bereich der Sehnenheilung spielt das Protein Scleraxis, eine große Rolle, da dieses maßgeblich für die Heilung von Sehnen durch Stimulation der Tenozyten und Synthese der extrazellulären Matrix verantwortlich ist. Kortikosteroide und NSAR hemmen die Expression dieses Transkriptionsfaktors und haben somit einen negativen Einfluss auf die Sehnenheilung (Chen et al., 2015). Gleiches wird auch den Lokalanästhetika nachgesagt.
Die Orthobiologie hat sich in der Behandlung von Sportverletzungen über die Jahre immer weiter etabliert und findet inzwischen relativ flächendeckende Anwendung. Auch wenn die Evidenz noch heterogen ist, zeigen zunehmend mehr Studien den positiven Effekt von ACP bei der Therapie von Knorpelschäden, beginnenden Arthrosen (Filardo et al., 2020) und bei der Behandlung von Sehnen- und Muskelpathologien (Xu et al., 2017; Grassi et al., 2018).
Die Ergebnisse bei intra- und postoperativer Injektion von PRP in Zusammenhang mit operativen Rotatorenmanschetten (RM) Rekonstruktionen zeigen im Langzeit Follow-Up keinen signifikanten Vorteil bezüglich Reruptur Raten oder MRT kontrollierten Einwachsverhalten. Dennoch sind die Untersuchungen bezüglich der Patienten Zufriedenheit bei Omarthrose und RM Partialrupturen vielversprechend wenn auch auf Langzeitverläufe nicht geprüft. Am Ellenbogengelenk konnte ein signifikanter Vorteil von PRP Injektionen gegenüber Cortison und Placebo nach 2 Jahren gezeigt werden (8).
PRP – Herstellung und Wirkmechanismen
Das thrombozytenreiche Plasma oder auch plättchenreiche Plasma (PRP) kann mittels unterschiedlicher Zentrifugations-Protokolle aus autologem venösem Patientenblut gewonnen werden. Durch die Plasmapherese werden aus den Thrombozyten Wachstumsfaktoren und Zytokine freigesetzt. Hierbei wurden in Studien bei der Sehnenheilung folgende Stoffe als maßgeblich identifiziert, Platelet derived growth factor (PDGF), epidermal growth factor (EGF), vascular endothelial growth factor, and transformin. Alle diese Stoffe sind in spezifischen Konzentrationen an der Wundheilung beteiligt. Nach einer Aktivierung können diese Stoffe direkt oder /und indirekt zu einer Geweberegeneration über die Stimulation und Proliferation von Fibroblasten und mesenchymalen Stammzellen führen. Insgesamt verfolgt die Injektion von PRP als Ziel, die Verstärkung der natürlichen Heilung durch ein Anheben der Cytokin Konzentrationen im Gewebe.
Wobei die Decodierung der genauen Reihenfolge, Zusammensetzung und Konzentrationen noch nicht abschließend gelungen ist. Auf der Suche nach der optimierten Zusammensetzung und Aktivierung verwenden die Anbieter bei der Aufbereitung unterschiedliche Zentrifugationsprotokolle sowie Zusatzstoffe. Ein seit über 10 Jahren im Einsatz befindliches PRP Produkt ist das ACP der Firma Arthrex, welches sich durch eine gleichzeitig niedrige Konzentration an Leukozyten auszeichnet. Andere Produktvarianten können durch adaptierte Zentrifugationsprotokolle eine höhere Thrombozytenkonzentration erreichen. Dies geht jedoch mit der Aufkonzentraion von pro-inflammatorischen Leukozyten einher.
Die benötigte Menge an venösem Blut bei ACP liegt bei 15ml Vollblut. Die Spritze ermöglicht eine sterile Verarbeitung in einem geschlossenen System. Nach der Zentrifugation wird das oben schwimmende Plasma separiert. Durch diese Verfahren kann eine 2-3-fache Konzentration an Thrombozyten in einem relativ kleinen Volumen erreicht werden. Die so gewonnene Menge an PRP liegt zwischen 4 und 6 ml und sollte zeitnah, spätesten in bis zu einer halben Stunde, verwendet werden.
Anwendung von PRP in der Orthopädie und Traumatologie
Schulter und Ellenbogen
Von der faszinierenden Idee getragen jegliche Gewebeheilung zu fördern, finden sich Fallstudien und Untersuchungen zur PRP Anwendung in allen Bereichen der Orthopädie und Traumatologie. Ein wissenschaftlicher Ansatz ist nur in wenigen hochqualitativ prospektiven Untersuchungen dokumentiert, und randomisierte klinische Studien mit längerer Laufzeit fehlen nahezu in fast allen Bereichen. Die eindeutige Evidenz eines positiven Effektes von PRP konnte in klinischen Untersuchungen am Menschen nach akuten Traumen oder postoperativ noch nicht erbracht werden (Gwinner et al., 2016; Holtby et al., 2016). Hingegen in der Anwendung bei chronischen Erkrankungen im Rahmen einer konservativen Therapie finden sich Studien die im Langzeit Verlauf bei Schulter- und Ellenbogen-Sehnenpathologien signifikante Vorteile der PRP Injektionen aufzeigen konnten (Arora et al., 2022). Die Mehrzahl der Literatur zur oberen Extremität beschäftigt sich mit dem Schultergelenk und nur wenige mit der Epicondylopathie des Ellenbogens.
Im Falle der chronischen Erkrankungen der Schulter befassen sich die meisten Studien mit kompletten oder inkompletten (PASTA) RM-Sehnenrupturen und dem damit oft vergesellschafteten Impingement Syndrom. Bei der Literatursuche fällt eine Unschärfe in der Patientenauswahl auf. Studien nehmen akute und chronische Verletzungen sowie operierte und konservativ therapierte Sehnen Rupturen in einer Gruppe auf. Die Ergebnisse in diesen Untersuchungen bezüglich der kurz- und Langzeit Ergebnisse für z.B. Funktion und Rerupturrate sind nicht signifikant unterschiedlich. Zusätzlich sind viele Daten der unterschiedlichen Reviews und Metaanalysen aus den gleichen, wenigen Primärquellen und wurden nur mit unterschiedlichen Fragestellungen analysiert. Randomisierte Studien mit großen Fallzahlen und Langzeitbeobachtungen über 6 Monaten sind sehr selten.
Aus der aktuell vorhanden primären Literatur und den Metanalysen lässt sich erkennen das PRP bei großen Sehnenläsionen, intra- und postoperativ und bei akuten Verletzungen zu keiner Verbesserung des Outcomes führt. (Flury et al., 2016)
Evidente Vorteile zur RM Rerupturrate finden sich hingegen bei kleinen bis mittleren Sehnenrissen (Jo et al., 2015) und degenerativen RM Läsionen (Pandey et al., 2016).
An der Schulter, bei den degenerativen Sehnenverletzungen und kleinen Rupturen scheint die Potenz der Wirkstoffe ausreichend, um positiv in den Heilungsprozess einzugreifen.
Dieser Umstand lenkt das Interesse auf die Epicondylopathien am Ellenbogen. Hier insbesondere die durch Mikroangiopathien hervorgerufenen chronischen Formen bei der es im zeitlichen Verlauf zu einer zunehmenden Sehnenschädigung bis zur Ablösung vom gesamten radialen Epicondyl kommen kann. Diese Formen der radialen Epicondylopathie lassen sich mittels Sonografie und MRT bildmorphologisch darstellen und klassifizieren. Die MRT Klassifikation von Nirschl beschreibt in vier Stufen die Morphologie des Extensorensehnenansatzes im zeitlichen Verlauf der akuten bis chronischen Epicondylopathie. In den Stufen Grad I bis Grad III ist die Sehne am Epicondyl humeri radial direkt ansitzend und im Grad IV abgelöst.
Nach den vorliegenden Erkenntnissen aus der Literatur über die Erfolge der PRP Therapie bei Sehnenpathologien der Rotatorenmanschette in kleinen und mittleren Rissformen könnten sich diese für die Epicondylopathie in den von Nirschl klassifizierten Graden I-III wiederfinden. In der aktuellen Literatur zur Therapie mit PRP Injektion finden sich erste Studien die dies belegen. Insbesondere bei der gezielten sonografisch unterstützen Injektion direkt in den pathologisch veränderten Sehnenbereich (Evans et al., 2018).
In einem Review von 2015 zum Thema der PRP Therapie bei chronischer Epicondylopathie beschreiben die Autoren noch eine Vielzahl von Einzelfallstudien und ungezielte Injektionen im Bereich des lateralen Ellenbogens mit einer inhomogenen Volumenangabe und verschiedenen Präparaten. Die Ergebnisse sind verständlicher Weise nicht reproduzierbar oder signifikant besser als nicht invasive Therapieformen.
In der aktuellsten prospektiv randomisierten Untersuchung aus 2022 zur Injektion von PRP vs Cortison vs Kochsalzlösung zeigen die Autoren signifikant bessere Ergebnisse für die PRP Therapie in Bezug auf Schmerzreduktion und Funktion nach 8 und 12 Wochen (Arora et al., 2022).
Eigene Fälle bestätigen diese Ergebnisse und veranlassen uns zu einer eignen Untersuchung in Bezug auf die notwendige Anzahl der Injektionen und die Aufbereitung der Vollblut Proben.
Ebenfalls auffällig sind die Reduktion der Operationsindikationen in der Gruppe der Grad III klassifizierten Patienten nach Nirschl mit chronischer radialer Epicondylopathie nach einer PRP Injektionstherapie. Diese Beobachtung wird durch die Arbeit von Hastie et al (Hastie et al., 2018) bestätigt. Die Arbeitsgruppe veröffentlichte 2018 eine Reduktion der Operationshäufigkeit von 87,5% nach PRP Injektionen bei chronischer lateraler Epcondylopathie.
Patella- und Achillessehne
Grundsätzlich müssen im klinischen Alltag die Akutverletzungen wie (Teil-) Rissen von den chronischen Pathologien (Tendinopathien) unterschieden werden, da sich die Behandlungskonzepte hier mitunter deutlich unterscheiden. Insbesondere ist die Genese der Verletzung eine unterschiedliche. Speziell bei der Behandlung der letztgenannten Pathologien muss für eine erfolgreiche Therapie die Behandlung mit PRP in ein detailliert abgestimmtes und individualisiertes Therapiekonzept integriert werden. Dies setzt eine genaue Analyse der Ursache der Verletzung hinsichtlich des Vorliegens von negativ einwirkenden meist biomechanischen Faktoren wie die funktionelle Beinachse, Fußfehlstellungen und die Rumpfstabilität und deren Behandlung voraus. Die Belastung der Patella- und Achillessehne stellt einen wichtigen Teil der Behandlung dar, da diese die Tenozyten stimuliert und die Kollegensynthese fördert. Zur Anwendung kommen u.a. das exzentrische Training, das Energy-Storage Loading und/ oder HSRT (Heavy Slow Resistence Training) sowie das PTLE (Progressive Tendon Loading Exercises) zur Anwendung (Malliaras et al., 2015; Breda et al., 2021). Zudem kann die Wirksamkeit von ACP durch die gleichzeitige Therapie mittels Stoßwelle oder ultraschallgesteuerte galvanische Elektrolyse (USGET) erhöht werden, da beide Verfahren die Tenozyten aktivieren. Letzt genanntes Verfahren wurde inzwischen in die Konsensusempfehlung der ESSKA zur Behandlung der Tendinopathien aufgenommen (Abat et al., 2018).
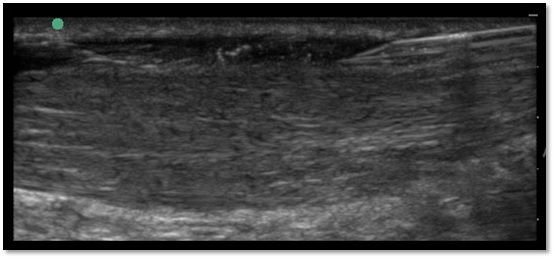
Die Applikation von ACP kann grundsätzlich intra- oder peritendinös erfolgen, wobei die intratendinöse Infiltration deutlich schmerzhafter für den Patienten ist. Das Outcome beider Applikationsarten ist gleich. Eine ultraschallgesteuerte (US) Infiltration kann zur exakten Platzierung des Präparats empfohlen werden, auch wenn beide Sehnen subkutan liegen (Abb. 1).
Abbildung 1 Ultraschallgesteuerte Infiltration der Achillessehne bei Mid-portion-Tendinose als peritendinöse Umflutung
Sollten deutliche peritendinöse Verklebungen vorliegen, können diese zudem durch das Vorspritzen von NaCl US-gesteuert aufgebrochen werden, um eine bessere Verteilung des ACPs um die Sehne herum zu erreichen. Auf die Verwendung von Lokalanästhetika sollte bekanntermaßen verzichtet werden.
Die Therapie mit PRP im Bereich der Sehne führt zu einer vermehrten Expression u.a. des Transkriptionsfaktors Scleraxis und fördert somit die Heilung der Sehne (Xu et al., 2017; Imai et al., 2019)). Dieser Effekt zeigte sich in vitro vor allem auch in der Frühphase der Heilung, so dass der Einsatz von ACP nach Achillessehnenrupturen im Rahmen der konservativen oder postoperativen Behandlung zeitnah nach Unfall sinnvoll erscheint.
Knorpelschäden und Früharthrose
Insbesondere in den Spielsportarten mit vielen stop-and-go Bewegungen sowie hohem Impact durch Sprünge finden wir mitunter bereits bei relativ jungen Athleten beginnenden Knorpelschäden, die gelegentlich schon das Stadium der Früharthrose zum Ende der aktiven Karriere erreichen oder sogar verantwortlich für die Beendigung dieser sind. Neben der Behandlung der Knorpelschaden selbst, steht die antiinflammatorische Therapie im Vordergrund, da die chronische Entzündungsreaktion im Knie zur weiteren Verschlechterung der Knorpelsituation mit beiträgt. Aufgrund der bekannten Nebenwirkungen und vor allem auch Wechselwirkungen mit anderen Medikamenten sollte die Verwendung von NSAR mit Bedacht erwogen werden. Die gute Wirksamkeit der Phytopharmaka wie Curcumin, Boswelia (Weihrauch), Anthocyane (Montmorency Sauerkirsche), Omega-3-Fettsäuren und Bromelain ist inzwischen klar erwiesen. Diese Substanzen bieten den Vorteil, dass sie kaum bis keine Nebenwirkungen haben, so dass sie meist bedenkenlos eingesetzt werden können. Beim Curcumin ist auf die Darreichungsform als Mizellen (in Fett gelöst) aufgrund der besseren Bioverfügbarkeit zu achten. Bromelain wirkt in höheren Dosierungen blutverdünnend, so dass der Einsatz in Kombination mit Heparinen und anderen Blutverdünnern limitiert ist. Auch die lokale Anwendung der Cryotherapie hilft, die Entzündungsreaktion zu reduzieren. Auch PRPs zeigen eine antiinflammatorische Wirkung insbesondere bei Vorliegen einer katabolen Stoffwechselsituation im Kniegelenk (Szwedowski et al., 2021), wie dies bei aktivierten Arthrosen der Fall ist. Die Wiederherstellung der intraartikulären Homöostase wird somit gefördert, was wiederum einen positiven Einfluss auf die Knorpelreparation hat.
Die intraartikuläre Applikation sollte bekanntermaßen unter sterilen Bedingungen erfolgen. Während die leukozytenreichen PRPs häufig eine deutliche Reaktion im Sinne von Schmerzen und einer möglichen Reizung des Gelenkes zeigen, findet sich dieser Effekt bei den leukozytenarmen PRPs wie ACP deutlich seltener bei der intraartikulären Verwendung. Ein verlängerter positiver Effekt nach 6 bis 12 Monaten konnte im Vergleich zu anderen verwendeten Substanzen gezeigt werden (Filardo et al., 2020). Aktuell in der Diskussion ist die kombinierte Verwendung von PRP und Hyaluronsäure. Einige Ergebnisse zeigen hier einen positiven Effekt, wobei auch hier die Ergebnisse noch heterogen sind. Schwierig hier ist vor allem der Aspekt der rechtlichen Sicherheit bei gleichzeitiger Applikation, da dies der Herstellung eines Medikaments entspricht.
Muskelverletzungen
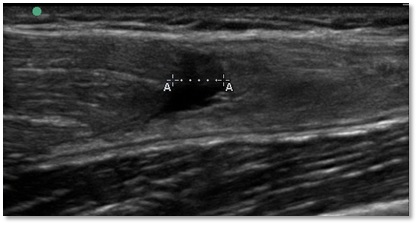
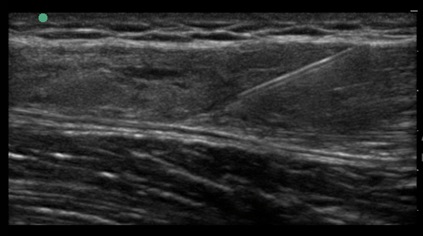
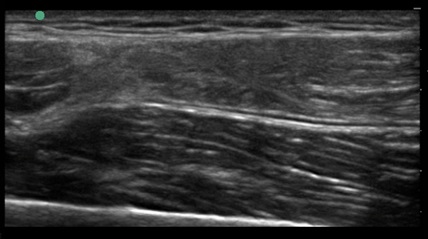
Der Einsatz von ACP bei Muskelverletzungen findet im Bereich Leistungs- und Profisport recht regelhaft Anwendung, wobei es vor allem die Sportler mit schweren Muskelverletzungen (ab Grad IIIb) sind, die von der Anwendung profitieren (Abb. 2).
Abbildung 2 a) Muskelbündelriss M. rectus femoris, b) Abpunktieren Hämatom und Infiltration mit ACP, c) Resultat 6 Wochen nach Unfall
Hier führt der Einsatz von PRP zu einem schnelleren Return-to-Sport, wobei Parameter wie Reduktion des Schmerzes, Muskelspannung und die re-injury-rate keine signifikanten Unterschiede zur Kontrollgruppe zeigen (Grassi et al., 2018).
Bei der Verwendung von PRP bei Muskelverletzungen sollten leukozytenarme PRPs wie das ACP zur Anwendung kommen, da zumindest im Tiermodell bei den leukozytenreichen PRPs vermehrt Fibrosierungen in der Muskulatur durch Stimulation des TGF-ß mit vermehrter Expression von Fibronectin beschrieben wurden. Die Verwendung von PRP-Exosomen führt im Tiermodell zu einer signifikant vermehrten Expression des Myogenin-Gens, während die Verwendung von mesenchymalen Stammzellen (MSC) die Expression von TGF-ß reduziert (Iyer et al., 2020). Beides hat einen günstigen Einfluss auf die Muskelheilung.
Die Behandlung sollte frühzeitig erfolgen, da dieses Gewebe einen schnellen Stoffwechsel hat, so dass auch die Abstände der Einzelinjektionen etwas enger gewählt werden können.
Nach schweren Muskelverletzungen gibt es immer wieder erneute Verletzungen der Muskulatur im ehemaligen Verletzungsbereich bzw. in der Nachbarschaft, obgleich die Muskulatur in der Bildgebung (Sonographie, MRT) eine gute Heilung gezeigt hat. Nicht selten ist die Ursache in einer unzureichenden Aktivierung/ Ansteuerung des betroffenen Muskels zu suchen, was entweder zu Verletzung der benachbarten Muskelgruppe aufgrund einer Überlastung durch Kompensation führt oder tatsächlich der vorverletzte Muskel erneut Schaden nimmt. Daher kann eine entsprechende Abklärung mittels Elektromyographie (EMG) sinnvoll sein, um eine solche Problematik zu erkennen und mittels entsprechenden Ansteuerungsübungen (ggf. EMG Biofeedback) zu beheben.
Zusammenfassung:
ACP hat bei der Behandlung von Sportverletzungen einen inzwischen festen Stellenwert, wobei die Einzelindikation immer gut überprüft und die Infiltrationsbehandlung in ein Gesamtbehandlungskonzept sinnvoll integriert werden sollte. Die Anwendung von PRP in kleinen und mittleren Sehnenpathologien bei Patienten mit Rotatorenmanschetten Rupturen und radialer Epicondylopathia humeri führt zu einer Reduktion der Beschwerden, Verbesserung der Funktion und kann Operationen verhindern. Dennoch bedarf es weiterer wissenschaftlicher Untersuchungen, um die Wirkmechanismen in ihrer Komplexität besser zu verstehen und somit die Behandlung weiter zu optimieren.

München

München

Bad Homburg
Literatur:
Abat, F. et al. (2018). Current trends in tendinopathy: consensus of the ESSKA basic science committee. Part II: treatment options. J. Exp. Orthop. 5.
Arora, K.K., Kapila, R., Kapila, S., Patra, A., Chaudhary, P., and Singal, A. (2022). Management of Lateral Epicondylitis: A Prospective Comparative Study Comparing the Local Infiltrations of Leucocyte Enriched Platelet-Rich Plasma (L-aPRP), Glucocorticoid and Normal Saline. Malaysian Orthop. J. 16: 58–69.
Breda, S.J., Oei, E.H.G., Zwerver, J., Visser, E., Waarsing, E., Krestin, G.P., and De Vos, R.J. (2021). Effectiveness of progressive tendon-loading exercise therapy in patients with patellar tendinopathy: a randomised clinical trial. Br. J. Sports Med. 55: 501–509.
Chen, W., Tang, H., Zhou, M., Hu, C., Zhang, J., and Tang, K. (2015). Dexamethasone inhibits the differentiation of rat tendon stem cells into tenocytes by targeting the scleraxis gene. J. Steroid Biochem. Mol. Biol. 152: 16–24.
Evans, J.P., Metz, J., Anaspure, R., Thomas, W.J., King, A., Goodwin, V.A., and Smith, C.D. (2018). The spread of Injectate after ultrasound-guided lateral elbow injection – a cadaveric study. J. Exp. Orthop. 5.
Filardo, G., Previtali, D., Napoli, F., Candrian, C., Zaffagnini, S., and Grassi, A. (2020). PRP Injections for the Treatment of Knee Osteoarthritis: A Meta-Analysis of Randomized Controlled Trials. Cartilage: 1947603520931170.
Flury, M., Rickenbacher, D., Schwyzer, H.K., Jung, C., Schneider, M.M., Stahnke, K., Goldhahn, J., and Audigé, L. (2016). Does Pure Platelet-Rich Plasma Affect Postoperative Clinical Outcomes After Arthroscopic Rotator Cuff Repair? A Randomized Controlled Trial. Am. J. Sports Med. 44: 2136–2146.
Grassi, A., Napoli, F., Romandini, I., Samuelsson, K., Zaffagnini, S., Candrian, C., and Filardo, G. (2018). Is Platelet-Rich Plasma (PRP) Effective in the Treatment of Acute Muscle Injuries? A Systematic Review and Meta-Analysis. Sports Med. 48: 971–989.
Gwinner, C., Gerhardt, C., Haneveld, H., and Scheibel, M. (2016). Two-staged application of PRP in arthroscopic rotator cuff repair: a matched-pair analysis. Arch. Orthop. Trauma Surg. 136: 1165–1171.
Hastie, G., Soufi, M., Wilson, J., and Roy, B. (2018). Platelet rich plasma injections for lateral epicondylitis of the elbow reduce the need for surgical intervention. J. Orthop. 15: 239–241.
Holtby, R., Christakis, M., Maman, E., MacDermid, J.C., Dwyer, T., Athwal, G.S., Faber, K., Theodoropoulos, J., Woodhouse, L.J., and Razmjou, H. (2016). Impact of Platelet-Rich Plasma on Arthroscopic Repair of Small- to Medium-Sized Rotator Cuff Tears: A Randomized Controlled Trial. Orthop. J. Sport. Med. 4.
Imai, S., Kumagai, K., Yamaguchi, Y., Miyatake, K., and Saito, T. (2019). Platelet-Rich Plasma Promotes Migration, Proliferation, and the Gene Expression of Scleraxis and Vascular Endothelial Growth Factor in Paratenon-Derived Cells In Vitro. Sports Health 11: 142–148.
Iyer, S.R., Scheiber, A.L., Yarowsky, P., Henn, R.F., Otsuru, S., and Lovering, R.M. (2020). Exosomes Isolated From Platelet-Rich Plasma and Mesenchymal Stem Cells Promote Recovery of Function After Muscle Injury. Am. J. Sports Med. 48: 2277–2286.
Jo, C.H., Shin, J.S., Shin, W.H., Lee, S.Y., Yoon, K.S., and Shin, S. (2015). Platelet-rich plasma for arthroscopic repair of medium to large rotator cuff tears: a randomized controlled trial. Am. J. Sports Med. 43: 2102–2110.
Kreuz, P.C., Steinwachs, M., and Angele, P. (2018). Single-dose local anesthetics exhibit a type-, dose-, and time-dependent chondrotoxic effect on chondrocytes and cartilage: a systematic review of the current literature. Knee Surg. Sports Traumatol. Arthrosc. 26: 819–830.
Malliaras, P., Cook, J., Purdam, C., and Rio, E. (2015). Patellar Tendinopathy: Clinical Diagnosis, Load Management, and Advice for Challenging Case Presentations. J. Orthop. Sports Phys. Ther. 45: 887–898.
Pandey, V., Bandi, A., Madi, S., Agarwal, L., Acharya, K.K.V., Maddukuri, S., Sambhaji, C., and Willems, W.J. (2016). Does application of moderately concentrated platelet-rich plasma improve clinical and structural outcome after arthroscopic repair of medium-sized to large rotator cuff tear? A randomized controlled trial. J. shoulder Elb. Surg. 25: 1312–1322.
Szwedowski, D., Szczepanek, J., Paczesny, Ł., Zabrzyński, J., Gagat, M., Mobasheri, A., and Jeka, S. (2021). The Effect of Platelet-Rich Plasma on the Intra-Articular Microenvironment in Knee Osteoarthritis. Int. J. Mol. Sci. 22.
Xu, K., Al-ani, M.K., Sun, Y., Xu, W., Pan, L., Song, Y., Xu, Z.L., Pan, X., and Yang, L. (2017). Platelet-rich plasma activates tendon-derived stem cells to promote regeneration of Achilles tendon rupture in rats. J. Tissue Eng. Regen. Med. 11: 1173–1184.